Bài tập cân bằng phương trình NaHCO3 + CH3COOH = CH3COONa + H2O + CO2 là một trong những bài tập được rất nhiều giáo viên của bộ môn hóa học ra rất nhiều trong đề kiểm tra 15 phút tại lớp. Và năm nào thì phương trình này cũng làm đau đầu các bạn học sinh.
Vì thế mà ngày hôm nay, dapanchuan.com sẽ giúp bạn giải bài tập này để ôn luyệ cho các kỳ kiểm tra. Tuy nhiên để hiểu rõ hơn về cân bằng phương trình thì chúng ta hãy cùng nhau ôn tạp lại một chút về cách thức giải cân bằng phương trình nhé.
Chi tiết cách giải bài tập: Cân bằng phương trình NaHCO3 + CH3COOH = CH3COONa + H2O + CO2
NaHCO3 là gì?
NaHCO3 hay còn gọi là Natri bicacbonat là chất rắn màu trắng có hình dạng tinh thể giống như bột mịn công thức hoá học là NaHCO3 có vị hơi mặn và có tính kiềm tương tự như loại soda dùng trong tẩy rửa.
NaHCO3 còn có tên gọi khác là Muối nở, bột nở, Sodium bicarcbonat, Natri hydrocacbonat, Backing soda. Do được NaHCO3 thường được dùng rất phổ biến trong thực phẩm nên nó còn có nhiều tên gọi khác: cooking soda, bicarbonate of soda… Dù soda là tên thông thường của các muối natri cacbonat Na2CO3 cũng như NaHCO3 nhưng trên thực tế thường gọi là natri bicacbonat là baking soda, còn natri cacbonat là soda..
CH3COOH là gì?
CH3COOH là công thức hóa học của axit axetic với tên tiếng anh là Acid Acetic. CH3COOH (Axit Axetic) là một hợp chất có tính axit cực mạnh, lỏng, không màu, có vị chua và tan vô hạn ở trong nước, dễ cháy, dễ bay hơi. CH3COOH (Axit Axetic) được tìm thấy và sử dụng từ rất lâu đời.
CH3COOH (Axit Axetic)được ứng dụng cao trong các ngành sản xuất công nghiệp, sản xuất thực phẩm hay lĩnh vực y học.. Ngoài ra, CH3COOH (Axit Axetic) còn có những tên gọi khác nhau như: etanoic, Hydro axetat (HAc), Ethylic acid, Axit metanecarboxylic, dấm, acetic acid, Acid ethanoic…
CH3COOH là một axit nên nó có những tính chất đặc trưng của một axit như làm giấy quỳ tím đổi màu thành hóa đỏ, tác dụng với bazơ tạo thành muối và nước, tác dụng với kim loại để giải phóng H2, tác dụng với muối của Axit yếu hơn, tác dụng với rượu tạo ra este và nước
Các phản ứng tác dụng với NaHCO3 là NaHCO3 + CH3COOH, NaHCO3 + KOH, NaHCO3 + NaCl, NaHCO3 + Na2CO3, NaHCO3 + Ba(OH)2, NaHCO3 + NaHSO4, NaHCO3 + H2SO4, NaHCO3 + BaCl2, NaHCO3 + HCl, NaHCO3 + NaOH, NaHCO3 + Ca(OH)2,
NaHCO3 + CH3COOH cùng kết hợp cần điều kiện gì?
Chỉ cần ở trong điều kiện bình thường thì với sự kết hợp của NaHCO3 + CH3COOH đã có thể xảy ra phản ứng
NaHCO3 + CH3COOH cùng kết hợp xảy ra hiện tượng gì?
Sau sự kết hợp giữa NaHCO3 + CH3COOH thì sẽ sinh ra phản ứng thu được muối CH3COONa và có khí CO2 thoát ra
Cách giải bài tập cân bằng phương trình NaHCO3 + CH3COOH = CH3COONa + H2O + CO2
| NaHCO3 | + | CH3COOH | → | CH3COONa | + | H2O | + | CO2 ↑ |
| natri hidrocacbonat | acid acetic | natri acetat | nước | Cacbon dioxit | ||||
| (rắn) (trắng) | (dung dịch)(không màu) | (rắn) (trắng) | (lỏng) (không màu) | (khí)(không màu) | ||||
| Muối | Muối |
Cách cân bằng Phương trình Hóa học
Đối với bộ môn Hóa học thì việc phải cân bằng những phương trình luôn là nỗi ám ảnh của các bạn học sinh. Nhưng thực ra việc cân bằng những phương trình hóa học này thật rất là đơn giản. Tuy nhiên, có những phương trình mà ở đó nhiều chất tham gia phản ứng và cho ra nhiều sản phẩm làm cho các bạn học sinh khi gặp phải đề khó sẽ bị rối không thể cân bằng được phương trình. Dưới đây là một số những phương pháp cân bằng phương trình giúp các bạn học sinhcó thể làm được những bài tập cân bằng phương trình hóa học một cách dễ dàng, nhanh chóng và chính xác nhất.
Trước hết các bạn học sinh cần ghi nhớ trình tự cân bằng một phương trình Hóa học:
Bước thứ 1: cân bằng nhóm nguyên tử (OH, NO3, SO4, CO2, PO4..)
Bước thứ 2: cân bằng nguyên tử Hidro
Bước thứ 3: cân bằng nguyên tử Oxi
Bước thứ 4: cân bằng các nguyên tố còn lại.
Cân bằng theo phương pháp truyền thống
Cách thực hiện:
Viết phương trình đã cho. Ở ví dụ này, bạn sẽ có:
- C3H8 + O2 –> H2O + CO2
- Phản ứng này xảy ra khi prôban (C3H8) được đốt cháy trong ôxy để tạo thành nước và cacbon điôxít.
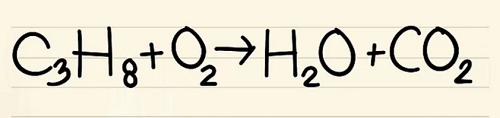
Bước 1:
Viết số lượng nguyên tử của mỗi nguyên tố mà bạn có ở mỗi bên phương trình. Xem các chỉ số dưới bên cạnh mỗi nguyên tử để tìm ra số lượng nguyên tử trong phương trình.
- Bên trái: 3 cacbon, 8 hyđrô và 2 ôxy.
- Bên phải: 1 cacbon, 2 hyđrô và 3 ôxy.
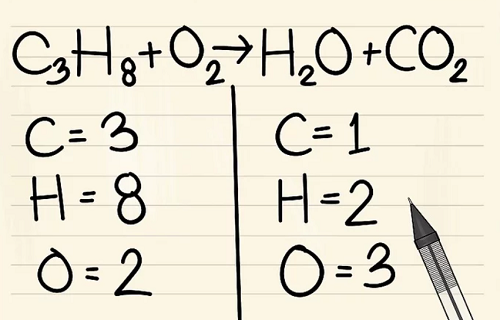
Bước 2:
Luôn để hyđrô và ôxy cuối cùng
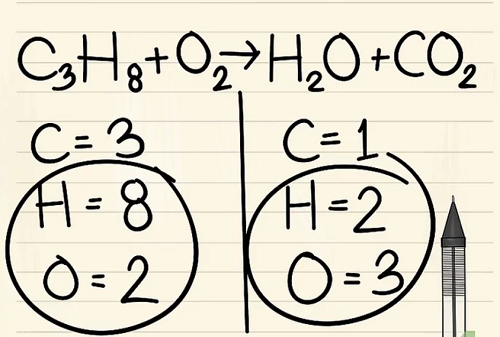
Bước 3:
Nếu bạn còn lại nhiều hơn một nguyên tố để cân bằng: hãy chọn nguyên tố xuất hiện chỉ trong phân tử đơn của chất phản ứng và chỉ trong phân tử đơn của sản phẩm. Điều này có nghĩa rằng bạn sẽ cần phải cân bằng các nguyên tử cacbon trước.
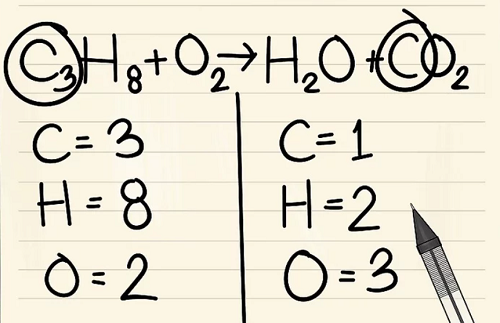
Bước 4:
Thêm hệ số cho đơn nguyên tử cacbon vào bên phải của phương trình để cân bằng nó với 3 nguyên tử cacbon ở bên trái của phương trình.
- C3H8 + O2 –> H2O + 3CO2
- Hệ số 3 đứng trước cacbon ở phía bên phải chỉ ra có 3 nguyên tử cacbon giống như chỉ số dưới 3 ở phía bên trái cho biết có 3 nguyên tử cacbon.
- Trong phương trình hóa học, bạn có thể thay đổi hệ số, nhưng không thể thay đổi chỉ số dưới.

Bước 5:
Tiếp đến là cân bằng nguyên tử hyđrô. Bạn có 8 nguyên tử hyđrô ở bên trái. Do đó bạn sẽ cần có 8 ở bên phải.
C3H8 + O2 –> 4H2O + 3CO2
Ở bên phải giờ bạn thêm 4 làm hệ số vì chỉ số dưới cho biết bạn đã có 2 nguyên tử hyđrô.
Khi bạn nhân hệ số 4 với chỉ số 2, bạn có 8.
6 nguyên tử Ôxy khác là từ 3CO2.(3×2=6 nguyên tử ôxy+ 4 nguyên tử ôxy khác=10)

Bước 6:
Cân bằng các nguyên tử ôxy.
Bởi vì bạn đã thêm hệ số vào các phân tử bên phải phương trình nên số nguyên tử ôxy đã thay đổi. Giờ bạn có 4 nguyên tử ôxy trong phân tử nước và 6 nguyên tử ôxy trong phân tử cacbon điôxít. Tổng cộng ta có 10 nguyên tử ôxy.
Thêm hệ số 5 vào phân tử ôxy ở bên trái phương trình. Giờ bạn có 10 phân tử ôxy ở mỗi bên.
C3H8 + 5O2 –> 4H2O + 3CO2.
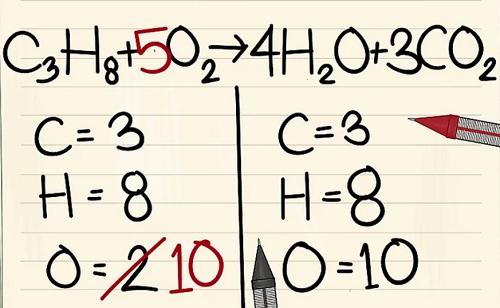
Kết quả
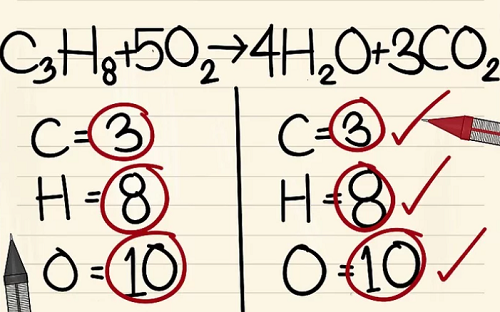
Cân bằng theo trình tự Kim loại – Phi kim
Cân bằng phương trình hóa học theo trình tự Kim loại – Phi kim có nghĩa là chúng ta sẽ cân bằng theo trình tự cân bằng số nguyên tử của kim loại trước rồi tới phi kim, sau đó tới Hidro và tới oxi.
Vd: CuFeS2 + O2 -> CuO + Fe2O3 + SO2
Do nguyên tử Cu đã cân bằng nên thứ tự cân bằng đầu tiên sẽ là: Fe sau đó sẽ là Cu, S, O rồi nhân đôi các hệ số ta có kết quả là:
4CuFeS2 + 13O2 = 4CuO + 2 Fe2O3 + 8SO2
Phương pháp cân bằng phương trình chẵn lẻ
Đây là một trong những cách thức có thể cân bằng phương trình hóa học dễ dàng và nhanh chóng được sử dụng phổ biến. Với phương pháp này các bạn học sinh có thể sử dụng phương pháp chẵn lẻ, được áp dụng như sau:
Khi mà một phương trình phản ứng đã cân bằng có nghĩa là số nguyên tử của nguyên tố ở vế phải sẽ bằng với số nguyên tử của nguyên tố ở vế trái, đồng nghĩa là số nguyên tử của một nguyên tố ở vế trái chẵn thì số nguyên tử của nguyên tố đó ở vế phải cũng phải chẵn.
Cho nên nếu trong phương trình mà nếu một trong số những số nguyên tử của bất kỳ nguyên tố nào còn lẻ thì phải nhân đôi.
Vd: Ta lấy lại ví dụ ở trên: Fe + O2 -> Fe2O3
Vế trái số nguyên tử của Fe lẻ còn bên phải thì chẵn nên ta nhân Fe ở vế trái lên 2. Còn oxi ở vế trái thì chẵn, vế phải thì lẻ, nên ta cũng nhân 2 cho số nguyên tử oxi ở vế phải.
2Fe + O2 -> 2Fe2O3
Đến đây số nguyên tử của cả 2 bên đều đã chẵn, ta chỉ việc cân bằng lại cho sô nguyên tử của 2 bên bằng nhau.
4Fe + 3O2 = 2Fe2O3
Phương pháp từ nguyên tố chung nhất
Phương pháp từ nguyên tố chung nhất có nghĩa là nguyên tố nào có mặt trong hầu hết các hợp chất trong phương trình cần cân bằng thì chúng ta sẽ chọn để cân bằng hệ số các phân tử trước.
Vd: Cu + HNO3 -> Cu(NO3)2 + NO + H20
Trong phương trình này, nguyên tố Oxi xuất hiện nhiều nhất trong hầu hết các hợp chất nên sẽ cân bằng Oxi trước, rồi tới các nguyên tố khác.
Vế trái có 8 oxi, vế phải có 3 oxi. Vậy bội số chung nhỏ nhất của 8 và 3 là 24, suy ra hệ số của HNO3 là 24/3=8
Vậy phản ứng cân bằng là: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Phương pháp cân bằng phương trình bằng cách dùng hệ số thập phân
Phương pháp này áp dụng như sau: đặt hệ số vào các chất tham gia phản ứng, có thể là số nguyên tố hoặc là phân số miễn sao cho số nguyên tử ở cả hai vế đều bằng nhau. Sau đó nhân lên để khử mẫu số chung ở 2 vế.
Vd: Fe + O2 -> Fe2O3
Trước tiên ta thêm hệ số vào sẽ thành : 2Fe + 3/2O2 -> Fe2O3
Lúc này số nguyên tử ở 2 vế đã bằng nhau. Sau đó chúng ta nhân lên để khử mẫu, ở phương trình sẽ nhân lên cho 2.
Kết quả là: 4Fe + 3O2 = 2Fe2O3
Phương pháp cân bằng phương trình bằng đại số
Học sinh đặt hệ số a, b, c… lần lượt vào các công thức ở 2 vế của phương trình và thiết lập các phương trình toán học chứa các ẩn trên theo nguyên tắc số nguyên tử của nguyên tố trước và sau phản ứng bằng nhau. Bạn sẽ được 1 hệ phương trình chứa các ẩn, giải hệ phương trình này và đưa hệ số tương ứng tìm dược vào phương trình phản ứng và khử mẫu (nếu cần).
Với bài toán cân bằng phương trình hóa học FeS2 + O2 –> Fe2O3 + SO2, ta thấy, ở vế trái số nguyên tử O2 là chẵn với bất kỳ hệ số nào trong khi đó vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp các hệ số còn lại. 2Fe2O3 –> 4FeS2 –> 8SO2 + 11O2, thay vào PTPU ta được phương trình cân bằng là 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
Hi vọng với bài viết cắc bạn sẽ biết cân bằng phương trình này rồi nhé NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. mong rằng sẽ gặp lại các bạn trong những bài tập khác