Bài tập giải cân bằng phương trình NaOH + NO2 = NaNO2 + H2O + NaNO3 là một trong những bài tập được nhiều bạn học sinh quan tâm vì nó xuất hiện trong rát nhiều các bài kiểm tra. Đây cũng là bài tập được yêu cầu giải đáp nhiều nhất, vì thế với bài viết ngày hoomnay chúng tôi sẽ giúp bạn giải bài tập này cũng như là hướng dẫn các bạn học sinh cách cân bằng chuẩn nhất nhé.
Cách cân bằng Phương trình Hóa học
Đối với bộ môn Hóa học thì việc phải cân bằng những phương trình luôn là nỗi ám ảnh của các bạn học sinh. Nhưng thực ra việc cân bằng những phương trình hóa học này thật rất là đơn giản. Tuy nhiên, có những phương trình mà ở đó nhiều chất tham gia phản ứng và cho ra nhiều sản phẩm làm cho các bạn học sinh khi gặp phải đề khó sẽ bị rối không thể cân bằng được phương trình. Dưới đây là một số những phương pháp cân bằng phương trình giúp các bạn học sinhcó thể làm được những bài tập cân bằng phương trình hóa học một cách dễ dàng, nhanh chóng và chính xác nhất.
Trước hết các bạn học sinh cần ghi nhớ trình tự cân bằng một phương trình Hóa học:
Bước thứ 1: cân bằng nhóm nguyên tử (OH, NO3, SO4, CO2, PO4..)
Bước thứ 2: cân bằng nguyên tử Hidro
Bước thứ 3: cân bằng nguyên tử Oxi
Bước thứ 4: cân bằng các nguyên tố còn lại.
Cách thực hiện:
Viết phương trình đã cho. Ở ví dụ này, bạn sẽ có:
- C3H8 + O2 –> H2O + CO2
- Phản ứng này xảy ra khi prôban (C3H8) được đốt cháy trong ôxy để tạo thành nước và cacbon điôxít.
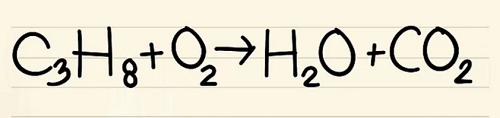
Bước 1:
Viết số lượng nguyên tử của mỗi nguyên tố mà bạn có ở mỗi bên phương trình. Xem các chỉ số dưới bên cạnh mỗi nguyên tử để tìm ra số lượng nguyên tử trong phương trình.
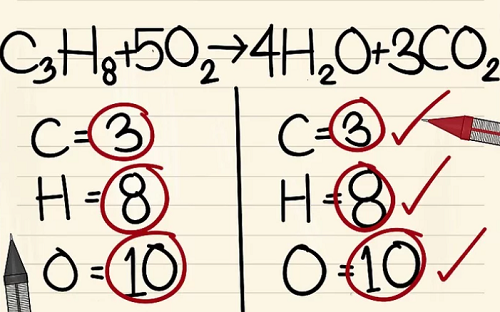
Bên trái: 3 cacbon, 8 hyđrô và 2 ôxy.
Bên phải: 1 cacbon, 2 hyđrô và 3 ôxy.
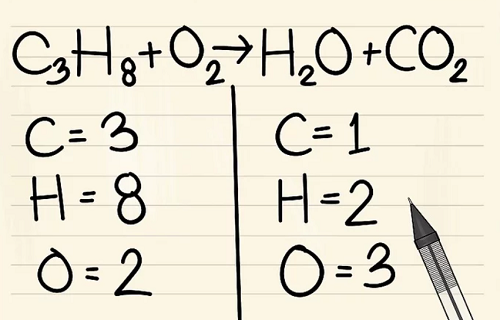
Bước 2:
Luôn để hyđrô và ôxy cuối cùng
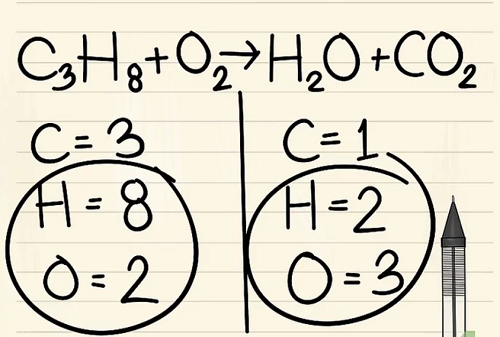
Bước 3:
Nếu bạn còn lại nhiều hơn một nguyên tố để cân bằng: hãy chọn nguyên tố xuất hiện chỉ trong phân tử đơn của chất phản ứng và chỉ trong phân tử đơn của sản phẩm. Điều này có nghĩa rằng bạn sẽ cần phải cân bằng các nguyên tử cacbon trước.
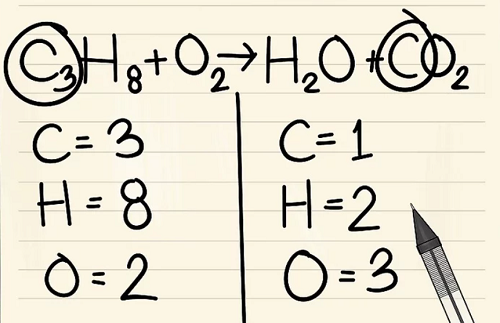
Bước 4:
Thêm hệ số cho đơn nguyên tử cacbon vào bên phải của phương trình để cân bằng nó với 3 nguyên tử cacbon ở bên trái của phương trình.
- C3H8 + O2 –> H2O + 3CO2
Hệ số 3 đứng trước cacbon ở phía bên phải chỉ ra có 3 nguyên tử cacbon giống như chỉ số dưới 3 ở phía bên trái cho biết có 3 nguyên tử cacbon.
Trong phương trình hóa học, bạn có thể thay đổi hệ số, nhưng không thể thay đổi chỉ số dưới.

Bước 5:
Tiếp đến là cân bằng nguyên tử hyđrô. Bạn có 8 nguyên tử hyđrô ở bên trái. Do đó bạn sẽ cần có 8 ở bên phải.
C3H8 + O2 –> 4H2O + 3CO2
Ở bên phải giờ bạn thêm 4 làm hệ số vì chỉ số dưới cho biết bạn đã có 2 nguyên tử hyđrô.
Khi bạn nhân hệ số 4 với chỉ số 2, bạn có 8.
6 nguyên tử Ôxy khác là từ 3CO2.(3×2=6 nguyên tử ôxy+ 4 nguyên tử ôxy khác=10)

Bước 6:
Cân bằng các nguyên tử ôxy.
Bởi vì bạn đã thêm hệ số vào các phân tử bên phải phương trình nên số nguyên tử ôxy đã thay đổi. Giờ bạn có 4 nguyên tử ôxy trong phân tử nước và 6 nguyên tử ôxy trong phân tử cacbon điôxít. Tổng cộng ta có 10 nguyên tử ôxy.
Thêm hệ số 5 vào phân tử ôxy ở bên trái phương trình. Giờ bạn có 10 phân tử ôxy ở mỗi bên.
C3H8 + 5O2 –> 4H2O + 3CO2.
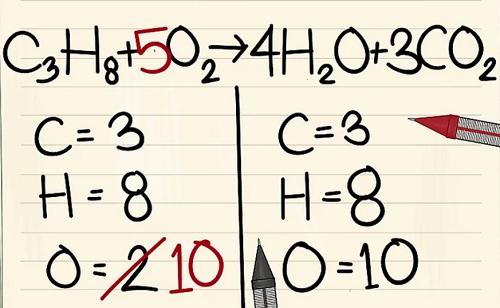
Kết quả
Chi tiết cách giải bài tập: Cân bằng phương trình NaOH + NO2 = NaNO2 + H2O + NaNO3
Tìm hiểu chất phản ứng
NaOH là gì?
NaOH là công thức hóa học của Natri hiđroxit hay còn gọi là Xút hoặc xút ăn da là một hợp chất vô cơ của natri. Natri hydroxit tạo thành dung dịch Bazơ mạnh khi hòa tan trong dung môi như nước.
NaOH nhúng vào giấy quỳ tím vào sẽ chuyển sang màu xanh. NaOH được ứng dụng nhất trong xử lý nước bể bơi, người ta dùng hóa chất NaOH để làm tăng nồng độ pH cho nước bể bơi.
NaOH dạng dung dịch tồn tại ở dạng lỏng, màu trắng, mùi đặc trưng, dùng trong hóa chất dệt nhuộm, luyện kim, y dược, thuốc trừ sâu, chất tẩy rửa và chất tẩy giặt, sản xuất giấy, sơn…Xút có phản ứng với các loại chất khử.
NaOH dễ hấp thụ CO2 trong không khí nên nó thường được bảo quản bằng bình có nắp kín. Ở trong dung dịch, xút tạo thành dạng monohydrat ở 12,3 – 61,8 độ C, nhiệt độ nóng chảy 65,1 độ C và tỷ trọng là 1,829 g/cm3.
NO2 là gì?
Khí NO2 là một hợp chất được cấu tạo từ nguyên tử nitơ và oxy tồn tại trong đất và nước với công thức NO2 . NO2 là một chất trung gian của phản ứng oxy hóa dưới tác động của các vi khuẩn từ amoniac biến đổi thành nitrite và sản phẩm cuối cùng thu được là nitrat.
Khí NO2 có màu nâu đỏ với mùi gắt đặc trưng. Khối lượng mol: 46.0055 g mol-1. Điểm nóng chảy: -11.2 oC (261.9 K và 11.8 oF). Điểm sôi: 21.2 oC (294.3 K và 70.2 oF). Khối lượng riêng: 1.88 g dm-3
Trong môi trường khí tự nhiên hiện nay, NO và NO2 là hai loại oxit nitơ thường gặp nhất. Khí NO2 được sinh ra do sự kết hợp giữa khí nitơ với oxy trong không khí khi ở nhiệt độ cao như do sét đánh, khí núi lửa, quá trình quá trình phân hủy vi sinh vật.
Trong khí quyển: khí NO2 khi kết hợp với gốc OH có trong không khí sẽ tạo ra HNO3. Vì vậy, khi trời mưa, NO2 cùng với các phân tử HNO3 sẽ hòa lẫn vào nước mưa và là giảm độ pH trong nước. Có thể nói, NO2 là một trong những tác nhân gây ra ô nhiễm không khí.
Khí NO2 còn được khuyến cáo là chất có thể gây ung thư do khi kết hợp với các axit amin có trong thực phẩm hằng ngày tạo nên hợp chất tiền ung thư là nitrosamine-1.
Tìm hiểu về sản phẩm tạo thành
NaNO2 là gì?
Natri nitrit với công thức hóa học là NaNO2, được dùng như một chất hãm màu và chất bảo quản trong thịt và cá. NaNO2 (Natri nitrit) khi ở dạng tinh khiết, NaNO2 (Natri nitrit) có dạng bột tinh thể màu trắng hơi ngả vàng. NaNO2 (Natri nitrit) tan rất tốt trong nước và là chất hút ẩm. NaNO2 (Natri nitrit) bị oxy hóa chậm trong không khí thành natri nitrat, NaNO3.
NaNO2 (Natri nitrit) còn được dùng trong việc sản xuất thuốc nhuộm điazo, các hợp chất nitroso, và các hợp chất hữu cơ khác; trong việc nhuộm và in lên vải, tẩy trắng vải; trong nhiếp ảnh; là chất phản ứng và chất ức chế trong phòng thí nghiệm; loại bỏ thiếc và phosphat hoá kim loại; và trong sản xuất cao su.
NaNO2 (Natri nitrit) có thể được dùng như một chất điện phân trong quy trình mài điện, tiêu biểu là dung dịch 10%. Natri nitrit còn đang được dùng trong thuốc chữa bệnh cho người và cho thú y như thuốc giãn mạch, thuốc giãn phế quản, và là thuốc giải độc cho ngộ độc xyanua.
NaNO3 là gì?
NaNO3 là công thức của hợp chất hoá học có tên gọi là Natri nitrat hay còn gọi là Muối diêm tiêu Chile hay diêm tiêu Peru. Hóa chất này là một chất rắn màu trắng tan tốt trong nước.
Hóa chất Natri nitrat được dùng trong nhiều lĩnh vực quan trọng như một chất nguyên liệu trong phân bón, nghề làm pháo hoa, bom khói, hóa chất thí nghiệm tinh khiết dùng làm chất bảo quản, thuốc đẩy tên lửa, thuỷ tinh hay men gốm.
Tên gọi khác: Muối diêm, xíu, Soda nitre, Chile saltpeter, Sodium saltpeter, Nitratine, Nitric acid sodium salt, Natriumnitrat.
H2O là gì ?
H2O là kí hiệu của 1 phân tử nước. Trong đó có 2 nguyên tố Hiđro và 1 Nguyên tố Ôxi. H2O là một chất lỏng không màu, không mùi, không vị , sôi ở 100 °C (ở áp suất khí quyển là 760 mmHg), hóa rắn ở 0 °C. H2O có thể hòa tan được nhiều chất rắn, lỏng và khí như: đường, muối ăn, axit, khí hidroclorua, khí amoniac…