Axit perchloric (HClO4) là một hợp chất hóa học mạnh mẽ và có tính ăn mòn cao. Nó được sử dụng trong nhiều ứng dụng công nghiệp, khoa học và y học. Trong thí nghiệm hóa học, một trong những thử nghiệm đơn giản nhất để kiểm tra độ axit của một dung dịch là sử dụng quỳ tím làm chỉ thị. Liệu HClO4 có làm đổi màu quỳ tím hay không? Đó là câu hỏi mà chúng ta sẽ cùng Dapanchuan.com tìm hiểu trong bài viết này.
HCLO4 là chất gì?
HClO4 là công thức hóa học của axit perchloric, một loại axit mạnh và không màu được sử dụng trong công nghiệp hóa chất để sản xuất các hợp chất perchlorat và các hợp chất khác. Axit perchloric cũng có thể được sử dụng trong các phản ứng oxi hóa, nit hóa và sulfon hóa.
Nó cũng có thể được sử dụng trong các phản ứng trùng hợp để sản xuất các hợp chất trung gian phức tạp hơn. Tuy nhiên, do tính chất mạnh và ăn mòn của nó, axit perchloric phải được sử dụng với cẩn thận và tuân thủ các quy định an toàn.
Cấu trúc của HCLO4
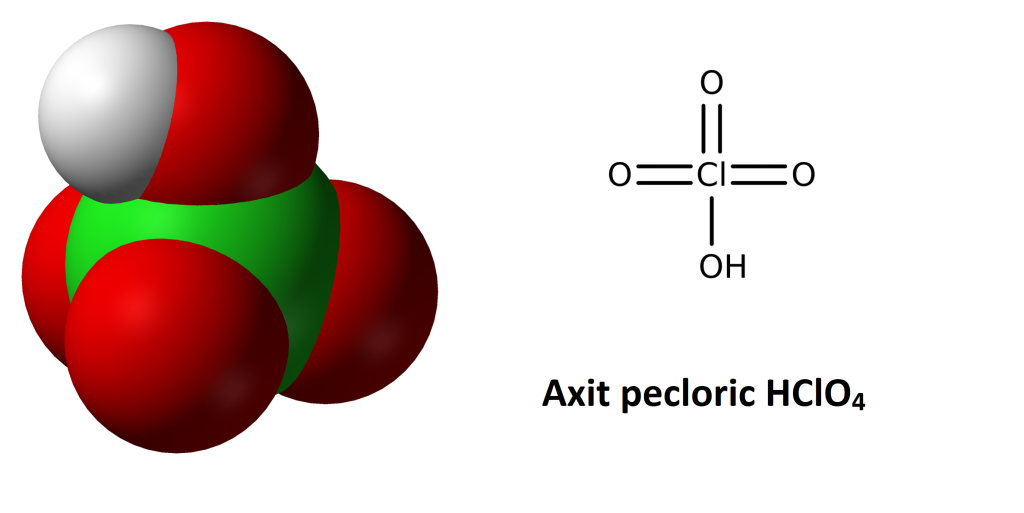
Cấu trúc của HClO4 là một phân tử tetrahedral, với nguyên tử clo (Cl) ở trung tâm và bốn nguyên tử oxy (O) nằm xung quanh. Nguyên tử clo kết nối với tất cả bốn nguyên tử oxy bằng các liên kết đơn, tạo thành một hình khối tứ diện.
Mỗi nguyên tử oxy còn lại được liên kết với một nguyên tử hydro (H) bằng một liên kết đơn, tạo thành các nhóm hydroxyl (OH) định hướng khác nhau. Cấu trúc này làm cho axit perchloric trở thành một chất lỏng không màu, mạnh mẽ và ăn mòn, với tính chất oxi hóa mạnh mẽ.
Tính chất vật lý của HCLO4
Dưới đây là các tính chất vật lý của axit perchloric (HClO4):
- Tên gọi: Axit perchloric
- Công thức hóa học: HClO4
- Khối lượng phân tử: 100.46 g/mol
- Trạng thái vật lý: Chất lỏng không màu
- Điểm nóng chảy: -73°C
- Điểm sôi: 203°C
- Khối lượng riêng: 1.77 g/cm³ (ở 25°C)
- Độ hòa tan: HClO4 tan trong nước và ethanol, tạo ra một dung dịch mạnh, ăn mòn và có tính oxi hóa
- mạnh.
- Tính ăn mòn: HClO4 là một chất ăn mòn mạnh, có thể gây tổn thương da và mắt nếu tiếp xúc trực tiếp.
- Nó cũng có thể phản ứng mạnh với các chất hữu cơ và vô cơ, tạo ra nguy hiểm.
- Tính chất oxi hóa: HClO4 là một chất oxi hóa mạnh và có thể oxi hóa nhiều hợp chất hữu cơ và vô cơ. Nó cũng có thể phản ứng với các chất khác như sulfur, sulfat và nitrat, tạo ra các hợp chất perchlorat.
- Tính chất khử: HClO4 cũng có thể hoạt động như một chất khử trong một số phản ứng, chẳng hạn như phản ứng với axit nitric để tạo ra nitrat.
Tính chất hóa học của HCLO4
Dưới đây là các tính chất hóa học của axit perchloric (HClO4):
- Tính chất oxi hóa mạnh: HClO4 là một chất oxi hóa mạnh, có thể oxi hóa các hợp chất hữu cơ và vô cơ thành các chất khác. Ví dụ, nó có thể oxi hóa ethanol (C2H5OH) thành axit acetic (CH3COOH).
- Tính chất khử: HClO4 có thể hoạt động như một chất khử trong một số phản ứng, chẳng hạn như phản ứng với axit nitric để tạo ra nitrat.
- Tính ăn mòn: HClO4 là một chất ăn mòn mạnh, có thể gây tổn thương da và mắt nếu tiếp xúc trực tiếp. Nó cũng có thể ăn mòn các chất hữu cơ và vô cơ, chẳng hạn như gỗ, da, kim loại, cao su, nhựa và nhiều chất khác.
- Tính chất trùng hợp: HClO4 có thể được sử dụng trong các phản ứng trùng hợp để tạo ra các hợp chất phức tạp hơn.
- Tính chất sulfon hóa: HClO4 có thể được sử dụng để sulfon hóa các hợp chất hữu cơ, tạo ra các hợp chất sulfonic.
- Tính chất nit hóa: HClO4 cũng có thể được sử dụng trong các phản ứng nit hóa để tạo ra các hợp chất nitro hữu cơ.
- Tuy nhiên, vì tính chất mạnh và ăn mòn của nó, axit perchloric phải được sử dụng với cẩn thận và tuân thủ các quy định an toàn.
HCLO4 có làm đổi màu quỳ tím không?
Axit perchloric (HClO4) không làm đổi màu quỳ tím. Quỳ tím là một chất chỉ thị pH và thường sử dụng để xác định tính axit hay bazơ của dung dịch. Khi quỳ tím được thả vào dung dịch axit, nó sẽ chuyển sang màu đỏ, trong khi trong dung dịch bazơ nó sẽ chuyển sang màu xanh.
Tuy nhiên, axit perchloric là một chất oxi hóa mạnh và có tính ăn mòn cao, có thể gây ra nguy hiểm và nên được sử dụng với cẩn thận. Khi tiếp xúc với các chất hữu cơ hay vô cơ, nó có thể gây ra các phản ứng ăn mòn mạnh và tạo ra các hợp chất nguy hiểm. Do đó, việc xử lý axit perchloric phải tuân thủ các quy định an toàn và được thực hiện trong các điều kiện an toàn.
HCLO4 có kết tủa không?
Axit perchloric (HClO4) thường không tạo kết tủa khi đưa vào nước hoặc các dung dịch khác. Vì đó là một axit mạnh, nó hoàn toàn tan trong nước để tạo thành dung dịch axit perchloric. Tuy nhiên, khi axit perchloric phản ứng với một số chất, chẳng hạn như amoni, kim loại kiềm, kim loại kiềm thổ hoặc hydrocarbon, có thể tạo ra các sản phẩm kết tủa như perchlorat của các kim loại hoặc muối perchloric.
Nói chung, khả năng tạo kết tủa của HClO4 phụ thuộc vào điều kiện phản ứng và các chất tham gia phản ứng. Trong các điều kiện thông thường, axit perchloric thường không tạo ra kết tủa.
HCLO4 có tan không?
Axit perchloric (HClO4) là một axit mạnh và hoàn toàn tan trong nước. Khi đưa axit perchloric vào nước, nó sẽ tương tác với phân tử nước để tạo thành các ion hydronium (H3O+) và perchlorat (ClO4-), cùng với một lượng nhiệt được thải ra. Phản ứng này là phản ứng giải nhiệt, có thể gây ra nguy hiểm và cần được thực hiện với cẩn thận.
Tuy nhiên, việc tan axit perchloric trong nước phải được thực hiện với cẩn thận và tuân thủ các quy định an toàn. Axit perchloric là một chất oxi hóa mạnh và có tính ăn mòn cao, có thể gây ra nguy hiểm cho sức khỏe và môi trường. Khi làm việc với axit perchloric, nên đeo kính bảo vệ, áo bảo hộ và găng tay bảo vệ để tránh tiếp xúc trực tiếp với axit và hít phải hơi axit.
Các phương pháp điều chế HCLO4
Axit perchloric (HClO4) được sản xuất thương mại thông qua một số phương pháp điều chế khác nhau, bao gồm:
- Phương pháp điện phân: Phương pháp này sử dụng điện phân dung dịch natri perchlorat (NaClO4) để tạo ra axit perchloric trong một tế bào điện phân. Quá trình này sẽ tách các ion natri (Na+) và perchlorat (ClO4-) để tạo thành axit perchloric.
- Phương pháp phối trộn: Phương pháp này sử dụng axit clohydric (HCl) và anhydrid perchloric (Cl2O7) để tạo ra axit perchloric. Trong quá trình phối trộn, anhydrid perchloric sẽ hấp thụ axit clohydric để tạo ra axit perchloric trong một phản ứng phức tạp.
- Phương pháp khử clo: Phương pháp này sử dụng phản ứng giữa clo (Cl2) và nước (H2O) để tạo ra axit perchloric. Trong quá trình này, clo sẽ tác dụng với nước để tạo thành axit clohydric (HCl) và axit perchloric.
Các phương pháp điều chế axit perchloric đều đòi hỏi sự chú ý và cẩn thận, vì nó là một chất oxi hóa mạnh và có tính ăn mòn cao. Việc sản xuất axit perchloric phải được thực hiện trong các điều kiện an toàn và kiểm soát để đảm bảo an toàn cho người làm và môi trường.
Ứng dụng của HCLO4 trong các lĩnh vực
Axit perchloric (HClO4) có nhiều ứng dụng trong các lĩnh vực khác nhau, bao gồm:
- Trong ngành công nghiệp: HClO4 được sử dụng để sản xuất các chất hóa học khác, bao gồm các muối perchlorat, peroxide và acid perchloric dùng trong sản xuất thuốc nổ, thuốc pháo, dược phẩm, tinh dầu, xúc tác hóa học và nhiều loại sản phẩm khác.
- Trong phân tích hóa học: HClO4 được sử dụng như một chất oxy hóa mạnh để oxi hóa các hợp chất hữu cơ và khoáng chất trong phân tích hóa học và kiểm tra chất lượng. Nó cũng được sử dụng để làm sạch các mẫu phân tích bằng cách loại bỏ các tạp chất và các hợp chất hữu cơ.
- Trong nghiên cứu khoa học: HClO4 được sử dụng trong nghiên cứu về các quá trình hóa học và vật lý, bao gồm các nghiên cứu về tương tác giữa các hợp chất hữu cơ và các ion kim loại.
- Trong công nghệ điện: HClO4 được sử dụng để tạo các điện cực và chất xúc tác trong các ứng dụng điện hóa, bao gồm sản xuất điện thoại di động và pin.
Tuy nhiên, cần lưu ý rằng HClO4 là một chất oxi hóa mạnh và có tính ăn mòn cao, có thể gây nguy hiểm cho sức khỏe và môi trường. Do đó, việc sử dụng HClO4 phải được thực hiện trong các điều kiện an toàn và tuân thủ các quy định an toàn liên quan.
Lưu ý khi sử dụng và bảo quản HCLO4
HClO4 là một chất oxi hóa mạnh và có tính ăn mòn cao, do đó việc sử dụng và bảo quản HClO4 cần tuân thủ các lưu ý sau:
- Sử dụng HClO4 trong môi trường thoáng khí và có đầy đủ thiết bị bảo vệ cá nhân, bao gồm mặt nạ, găng tay và áo phản quang.
- Tránh tiếp xúc trực tiếp với HClO4. Nếu tiếp xúc với da hoặc mắt, cần rửa kỹ với nước và tham khảo ý kiến của bác sĩ.
- Không hít phải hơi HClO4. Hơi này có thể gây kích thích đường hô hấp và gây nguy hiểm đối với sức khỏe.
- Không để HClO4 tiếp xúc với các chất hữu cơ, dầu mỡ và các chất dễ cháy. Nó cũng không nên được lưu trữ gần các chất dễ cháy hoặc oxi hóa.
- Bảo quản HClO4 ở nhiệt độ phòng và trong một không gian khô ráo, được giữ trong bình kín và đóng kín sau khi sử dụng.
- Không để HClO4 tiếp xúc với kim loại hoặc các vật liệu nhạy cảm với acid mạnh. Nó cũng không nên được lưu trữ trong bình kim loại.
- Tránh va chạm và rung động với HClO4, vì nó có thể gây nổ hoặc phát ra hơi độc.
Để sử dụng HClO4 trong các điều kiện an toàn, cần thực hiện các biện pháp bảo vệ và tuân thủ các quy định an toàn liên quan đến việc xử lý, sử dụng và bảo quản chất này.
Như vậy qua bài viết chúng ta đã biết câu trả lời cho câu hỏi “HCLO4 có làm đổi màu quỳ tím không?” là không. Tuy nhiên, HClO4 vẫn có nhiều ứng dụng quan trọng trong công nghiệp, khoa học và y học. Việc sử dụng và bảo quản chúng cần phải tuân thủ các quy định an toàn cụ thể để tránh gây ra các rủi ro cho sức khỏe và môi trường.