Bài tập cân bằng phương trình NaOH + KCl = NaCl + KOH giải cân bằng phương trình là một trong những bài tập được các thầy cô môn hóa đưa vào bài kiểm tra. Vì vậy đây là bài tập mà các bạn mong Dapanchuan hướng dẫn giải nhất. Hiểu được vấn đề đó chúng tôi sẽ giúp các bạn tìm hiểu về cách giải phương trình chung cũng như là cách giải riêng của bài tập này nhé. Nào chúng ta cùng bắt đầu nào:
Cách cân bằng Phương trình Hóa học
Đối với bộ môn Hóa học thì việc phải cân bằng những phương trình luôn là nỗi ám ảnh của các bạn học sinh. Nhưng thực ra việc cân bằng những phương trình hóa học này thật rất là đơn giản. Tuy nhiên, có những phương trình mà ở đó nhiều chất tham gia phản ứng và cho ra nhiều sản phẩm làm cho các bạn học sinh khi gặp phải đề khó sẽ bị rối không thể cân bằng được phương trình. Dưới đây là một số những phương pháp cân bằng phương trình giúp các bạn học sinhcó thể làm được những bài tập cân bằng phương trình hóa học một cách dễ dàng, nhanh chóng và chính xác nhất.
Trước hết các bạn học sinh cần ghi nhớ trình tự cân bằng một phương trình Hóa học:
Bước thứ 1: cân bằng nhóm nguyên tử (OH, NO3, SO4, CO2, PO4..)
Bước thứ 2: cân bằng nguyên tử Hidro
Bước thứ 3: cân bằng nguyên tử Oxi
Bước thứ 4: cân bằng các nguyên tố còn lại.
Cách thực hiện:
Viết phương trình đã cho. Ở ví dụ này, bạn sẽ có:
C3H8 + O2 –> H2O + CO2
Phản ứng này xảy ra khi prôban (C3H8) được đốt cháy trong ôxy để tạo thành nước và cacbon điôxít.
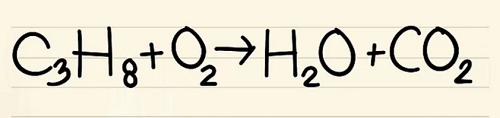
Bước 1:
Viết số lượng nguyên tử của mỗi nguyên tố mà bạn có ở mỗi bên phương trình. Xem các chỉ số dưới bên cạnh mỗi nguyên tử để tìm ra số lượng nguyên tử trong phương trình.
Bên trái: 3 cacbon, 8 hyđrô và 2 ôxy.
Bên phải: 1 cacbon, 2 hyđrô và 3 ôxy.
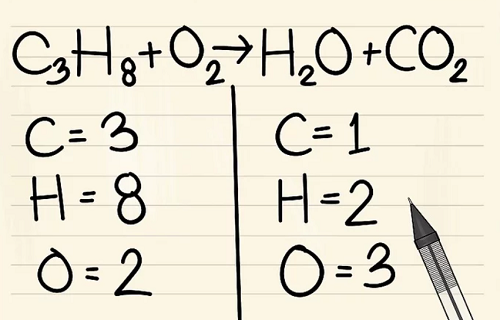
Bước 2:
Luôn để hyđrô và ôxy cuối cùng
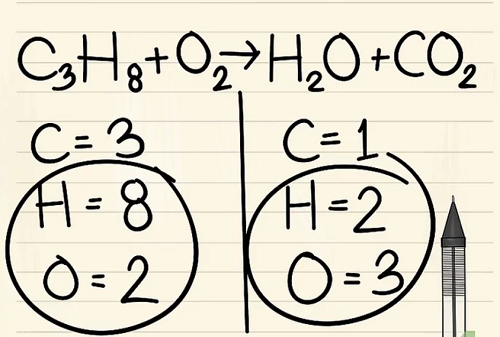
Bước 3:
Nếu bạn còn lại nhiều hơn một nguyên tố để cân bằng: hãy chọn nguyên tố xuất hiện chỉ trong phân tử đơn của chất phản ứng và chỉ trong phân tử đơn của sản phẩm. Điều này có nghĩa rằng bạn sẽ cần phải cân bằng các nguyên tử cacbon trước.
Bước 4:
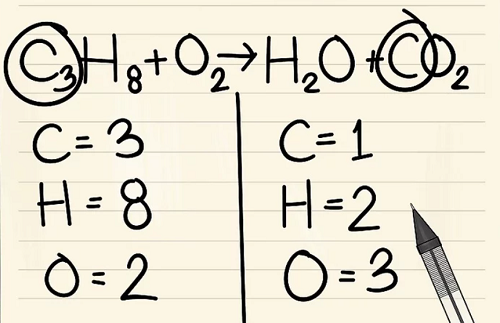
Thêm hệ số cho đơn nguyên tử cacbon vào bên phải của phương trình để cân bằng nó với 3 nguyên tử cacbon ở bên trái của phương trình.
- C3H8 + O2 –> H2O + 3CO2
Hệ số 3 đứng trước cacbon ở phía bên phải chỉ ra có 3 nguyên tử cacbon giống như chỉ số dưới 3 ở phía bên trái cho biết có 3 nguyên tử cacbon.
Trong phương trình hóa học, bạn có thể thay đổi hệ số, nhưng không thể thay đổi chỉ số dưới.

Bước 5:
Tiếp đến là cân bằng nguyên tử hyđrô. Bạn có 8 nguyên tử hyđrô ở bên trái. Do đó bạn sẽ cần có 8 ở bên phải.
C3H8 + O2 –> 4H2O + 3CO2
Ở bên phải giờ bạn thêm 4 làm hệ số vì chỉ số dưới cho biết bạn đã có 2 nguyên tử hyđrô.
Khi bạn nhân hệ số 4 với chỉ số 2, bạn có 8.
6 nguyên tử Ôxy khác là từ 3CO2.(3×2=6 nguyên tử ôxy+ 4 nguyên tử ôxy khác=10)

Bước 6:
Cân bằng các nguyên tử ôxy.
Bởi vì bạn đã thêm hệ số vào các phân tử bên phải phương trình nên số nguyên tử ôxy đã thay đổi. Giờ bạn có 4 nguyên tử ôxy trong phân tử nước và 6 nguyên tử ôxy trong phân tử cacbon điôxít. Tổng cộng ta có 10 nguyên tử ôxy.
Thêm hệ số 5 vào phân tử ôxy ở bên trái phương trình. Giờ bạn có 10 phân tử ôxy ở mỗi bên.
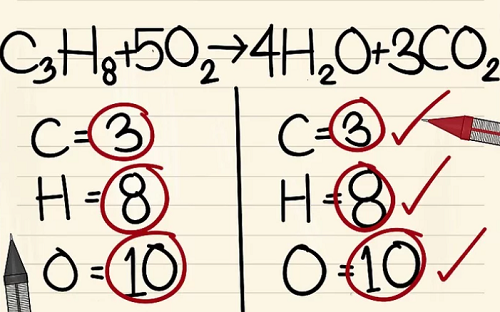
C3H8 + 5O2 –> 4H2O + 3CO2.
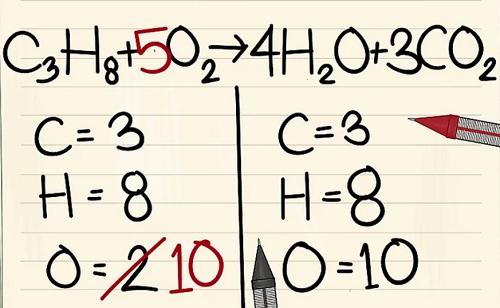
Kết quả
Chi tiết cách giải bài tập: Cân bằng phương trình NaOH + KCl = NaCl + KOH
Tìm hiểu chất phản ứng
NaOH là gì?
NaOH là công thức hóa học của Natri hiđroxit hay còn gọi là Xút hoặc xút ăn da là một hợp chất vô cơ của natri. Natri hydroxit tạo thành dung dịch Bazơ mạnh khi hòa tan trong dung môi như nước.
NaOH nhúng vào giấy quỳ tím vào sẽ chuyển sang màu xanh. NaOH được ứng dụng nhất trong xử lý nước bể bơi, người ta dùng hóa chất NaOH để làm tăng nồng độ pH cho nước bể bơi.
NaOH dạng dung dịch tồn tại ở dạng lỏng, màu trắng, mùi đặc trưng, dùng trong hóa chất dệt nhuộm, luyện kim, y dược, thuốc trừ sâu, chất tẩy rửa và chất tẩy giặt, sản xuất giấy, sơn…Xút có phản ứng với các loại chất khử.
NaOH dễ hấp thụ CO2 trong không khí nên nó thường được bảo quản bằng bình có nắp kín. Ở trong dung dịch, xút tạo thành dạng monohydrat ở 12,3 – 61,8 độ C, nhiệt độ nóng chảy 65,1 độ C và tỷ trọng là 1,829 g/cm3.