Etilen chắc không còn là cái tên xa lạ đối với các bạn học sinh. Etilen được biết đến nhiều nhất với công dụng là thường làm cho trái quả chín nhanh. Vậy với bài viết hôm nay, dapanchuan.com sẽ giúp bạn tìm hiểu về Tài liệu cách điều chế Etilen trong phòng thí nghiệm chuẩn
Etilen là gì?
Etilen hay còn gọi là Ethylene là một chất khí, một trong các loại hidrocacbon và là một anken (alkene) đơn giản nhất có công thức hóa học là C2H4 hay CH2=CH2.
Etilen chính là một trong những chất khí sinh học đầu tiên mà con người biết đến, là loại khí Olefin đơn giản nhất. Vì thế Etilen rất gần gũi với đời sống chúng ta, thậm chí ngay chính trong gia đình mình.
Tính chất vật lí của khí Etilen
Etilen là chất khí không màu, không mùi, nhẹ hơn không khí, ít tan trong nước, dễ bắt cháy và có mùi ngọt nhẹ của xạ hương.
Tính chất hóa học của Etilen
Phản ứng oxi hóa
Khi etilen cháy hoàn toàn tạo ra CO2 cùng H2O và phản ứng tỏa nhiều nhiệt
C2H4 + 3O2 → 2CO2 + 2H2O
Phản ứng cộng
Tác dụng với dung dịch brom (làm đổi màu dung dịch Br, mất màu)
C2H4 + Br2 → C2H4Br2
Phản ứng với clo
CH2 = CH2 + Cl2 → CH2=CH2Cl – HCl
Phản ứng cộng hidro
C2H4 +H2 -> C2H6
Phản ứng cộng axit
CH2= CH2 + HCl (khí) → CH3CH2Cl
C2H4 + HBr -> C2H5Br
Phản ứng cộng nước (có điều kiện nhiệt độ và sự xúc tác của axit)
C2H4 + H2O → C2H5OH
Phản ứng trùng hợp
Ở trong điều kiện thích hợp, liên kết kém bền trong phân tử etilen bị đứt ra dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo ra một chất có phân tử lượng rất lớn được gọi là polime.
…+ CH2 = CH2 + CH2 = CH2 +… → … – CH2 – CH2 – CH2 – CH2 – …
Tính chất hóa học của Etilen
1. Phản ứng oxi hóa
Khi etilen cháy hoàn toàn tạo ra CO2 cùng H2O và phản ứng tỏa nhiều nhiệt
C2H4 + 3O2 → 2CO2 + 2H2O
2. Phản ứng cộng
Tác dụng với dung dịch brom (làm đổi màu dung dịch Br, mất màu)
C2H4 + Br2 → C2H4Br2
Phản ứng với clo
CH2 = CH2 + Cl2 → CH2=CH2Cl – HCl
Phản ứng cộng hidro
C2H4 +H2 -> C2H6
Phản ứng cộng axit
CH2= CH2 + HCl (khí) → CH3CH2Cl
C2H4 + HBr -> C2H5Br
Phản ứng cộng nước (có điều kiện nhiệt độ và sự xúc tác của axit)
C2H4 + H2O → C2H5OH
3. Phản ứng trùng hợp
Ở trong điều kiện thích hợp, liên kết kém bền trong phân tử etilen bị đứt ra dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo ra một chất có phân tử lượng rất lớn được gọi là polime.
…+ CH2 = CH2 + CH2 = CH2 +… → … – CH2 – CH2 – CH2 – CH2 – …
Ứng dụng của Etilen
Ứng dụng của etilen trong công nghiệp, đời sống
Là nguyên liệu quan trọng trong công nghiệp tổng hợp polime cùng các chất hữu cơ khác
Dùng etilen thu được các polime để chế tạo ra màng mỏng dùng trong nhiều mục đích khác nhau. Chuyển hóa etilem thành những monome khác để tổng hợp ra hàng loạt các polime đáp ứng như cầu đa dạng của đời sống và kỹ thuật.
Từ etilem có thể tổng hợp ra nhiều hóa chất hữu cơ thiết yếu khác như etanol, etilen oxit, etylen glicol,…
Ứng dụng trong các lĩnh vực: sản xuất bao bì, vận chuyển, ngành điện tử, diệt may, chết tạo ra chất phủ và chất kết dính, là nguyên liệu trong vật liệu xây dựng, ứng dụng trong ngành hóa dầu và dẫn xuất.
Ứng dụng của etilen trong nông nghiệp
Làm tăng sự sinh trưởng của các tế bào thực vật
Dùng trong kích thích sự nảy mầm và sinh trưởng của các loại cây trồng, cây cối
Giúp tăng năng suất cây trồng, phục vụ cho các ngành nông nghiệp trồng trọt, canh tác
Đặc biệt, ứng dụng trong việc kích thích quả mau chín.
Etilen C2H4 nguy hiểm thế nào?
Etilen là một khí không độc nhưng có thể gây ngạt thở nếu môi trường chứa quá nhiều khí này và thiếu oxy.
Nó là một chất khí không màu, không mùi nên rất khó để phân biệt việc khí ethylene có đang tích tụ trong phòng kín hay không.
Hít quá nhiều khí ethylene gây ra hiện tượng mất nhận thức, gây mê thậm chí cả tử vong do ngạt thở. Ngoài ra, nếu tiếp xúc nó ở dạng lỏng khi không có đồ bảo hộ sẽ gây tê và các mô phơi nhiễm sẽ bị đông cứng.
Etilen rất dễ bắt cháy nên không được để khí này lọt ra ngoài nơi đang có lửa hay dùng đồ gây nổ, cháy trong môi trường có khí etilen.
Các bình chứa etilen đều chứa áp lực cao, tránh trường hợp bình bị rò rỉ ra. Cần thường xuyên kiểm tra các bình chứa etilen.
Cách điều chế Etilen trong phòng thí nghiệm chuẩn
Chuẩn bị điều chế Etilen
- Dung cụ: Ống nghiệm, kẹp gỗ, đèn cồn, ống hút nhỏ giọt, nút cao su có ống dẫn khí, diêm, bông, ống thủy tinh, ống dẫn cao su, giá đỡ ống nghiệm, ống vuốt nhọn, …
- Hóa chất: H2SO4 đặc, ancol etylic khan, dung dịch KMnO4, NaOH đặc.
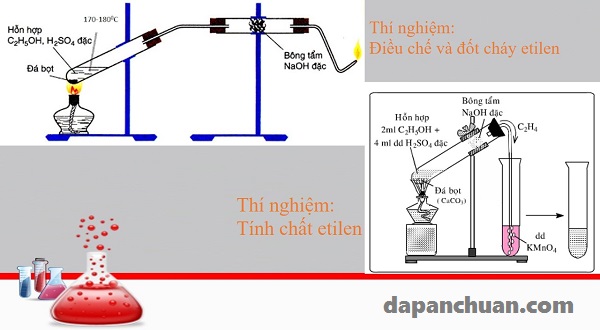
Tiến hành thí nghiệm điều chế Etilen
Cho 2ml ancol etylic khan vào ống nghiệm khô có sẵn vài viên đá bọt.
Sau đó thêm từng giọt dung dịch H2SO4 đặc (4ml), đồng thời lắc đều. Lắp dụng cụ thí nghiệm như hình.
Lưu ý:
- Đun nóng hỗn hợp phản ứng sao cho hỗn hợp không được quá sôi nếu không sẽ trào lên ống dẫn khí.
- Đốt khí sinh ra ở đầu vuốt nhọn của ống dẫn khí.
- Dẫn khí vào ống nghiệm chứa KMnO4. Quan sát sự thay đổi màu của dung dịch.
Hiện tượng và giải thích khi điều chế Etilen
| Tiến hành | Hiện tượng | Phương trình và giải thích |
| Đun nóng hỗn hợp ancol etylic khan và H2SO4 | Dung dịch sủi bọt và có khí thoát ra. |  Đây là phản ứng điều chế etilen trong phòng thí nghiệm.Thêm đá bọt vào để dung dịch sôi đều. Đây là phản ứng điều chế etilen trong phòng thí nghiệm.Thêm đá bọt vào để dung dịch sôi đều. |
| Đốt cháy khí sinh ra. Đưa nắp chén sứ vào ngọn lửa đang cháy. | Ngọn lửa có màu xanh nhạt, khi đưa nắp chén sứ vào thì thấy có muội than bám trên nắp chén sứ. |  Các chất hữu cơ đều dễ cháy, sinh ra khí CO2 và hơi nước, kèm muội than.Trong quá trình đốt cháy, ta đưa nắp chén sứ vào sẽ ngăn cản sự tiếp xúc của khí với oxi nên có sinh ra muội than. Các chất hữu cơ đều dễ cháy, sinh ra khí CO2 và hơi nước, kèm muội than.Trong quá trình đốt cháy, ta đưa nắp chén sứ vào sẽ ngăn cản sự tiếp xúc của khí với oxi nên có sinh ra muội than. |
| Dẫn khí tạo thành qua dung dịch KMnO4. | Màu dung dịch KMnO4 nhạt dần, xuất hiện kết tủa màu đen. |  Liên kết đôi trong phân tử etilen bị oxi hoá bởi KMnO4 tạo thành etilen glicol và MnO2 kết tủa đen. Liên kết đôi trong phân tử etilen bị oxi hoá bởi KMnO4 tạo thành etilen glicol và MnO2 kết tủa đen. |
Mong rằng với bài viết này các bạn đã có thể thu thập được Tài liệu cách điều chế Etilen trong phòng thí nghiệm chuẩn để từ đó có thể tự mình thực hiện việc điều chế Etilen này trong phòng thí nghiệm vào 1 dịp gần nhất nhé.