Phương trình hóa học: Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Cân bằng phương trình:
Tùy theo từng điều kiện phản ứng mà Fe tác dụng với H2SO4 có thể sinh ra các chất khác nhau. Để tìm hiểu cách giải và cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O, mọi người hãy cùng theo dõi những chia sẻ dưới đây của Đáp Án Chuẩn.
Điều kiện phản ứng Fe ra Fe2(SO4)3
Phản ứng để chuyển đổi sắt (Fe) thành sắt sulfat (Fe2(SO4)3) có thể được thực hiện bằng cách cho sắt phản ứng với axit sunfuric (H2SO4) để tạo thành sắt sulfat và khí sunfurơ (SO2) và nước (H2O), theo phương trình sau:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Để phản ứng này diễn ra tốt, cần có các điều kiện sau:
- Axit sulfuric phải có độ tinh khiết cao, tức là phải sử dụng axit sulfuric đậm đặc (hàm lượng H2SO4 ≥ 98%) để đảm bảo đủ nồng độ và khả năng phản ứng.
- Phải sử dụng sắt tinh khiết để đảm bảo chất lượng của sản phẩm Fe2(SO4)3.
- Cần cung cấp đủ nhiệt độ để phản ứng diễn ra nhanh chóng. Nhiệt độ thích hợp cho phản ứng này là khoảng từ 150 đến 200 độ C.
- Cần duy trì môi trường axit, đó là môi trường có độ pH thấp (khoảng 2 đến 3), bằng cách thêm axit sulfuric vào hỗn hợp phản ứng để duy trì môi trường axit trong suốt quá trình phản ứng.
- Cần sử dụng lò đun kín để tránh khí SO2 thoát ra ngoài không khí, gây ô nhiễm môi trường và nguy hiểm cho sức khỏe.
Phương trình ion rút gọn khi cho Fe tác dụng với H2SO4
Phương trình ion rút gọn cho phản ứng giữa Fe và H2SO4 là:
Fe + H2SO4 → FeSO4 + H2
Trong đó, Fe (sắt) tác dụng với H2SO4 (axit sulfuric) tạo ra FeSO4 (sắt sunfat) và H2 (hydro).
Điều kiện để phản ứng xảy ra là cần có nhiệt độ và chất xúc tác, ví dụ như Cu (đồng) hoặc Pt (bạch kim) để tăng tốc độ phản ứng.
Phản ứng này có tính oxi-hoá khử, trong đó sắt bị oxi hóa và axit sulfuric bị khử.
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O là dạng phản ứng gì?
Phản ứng này là phản ứng oxi-hoá khử, trong đó sắt (Fe) bị oxi hóa và axit sulfuric (H2SO4) bị khử. Phản ứng tạo ra muối sunfat sắt (III) Fe2(SO4)3, khí lưu huỳnh dioxide (SO2) và nước (H2O).
Phản ứng có dạng tổng quát là:
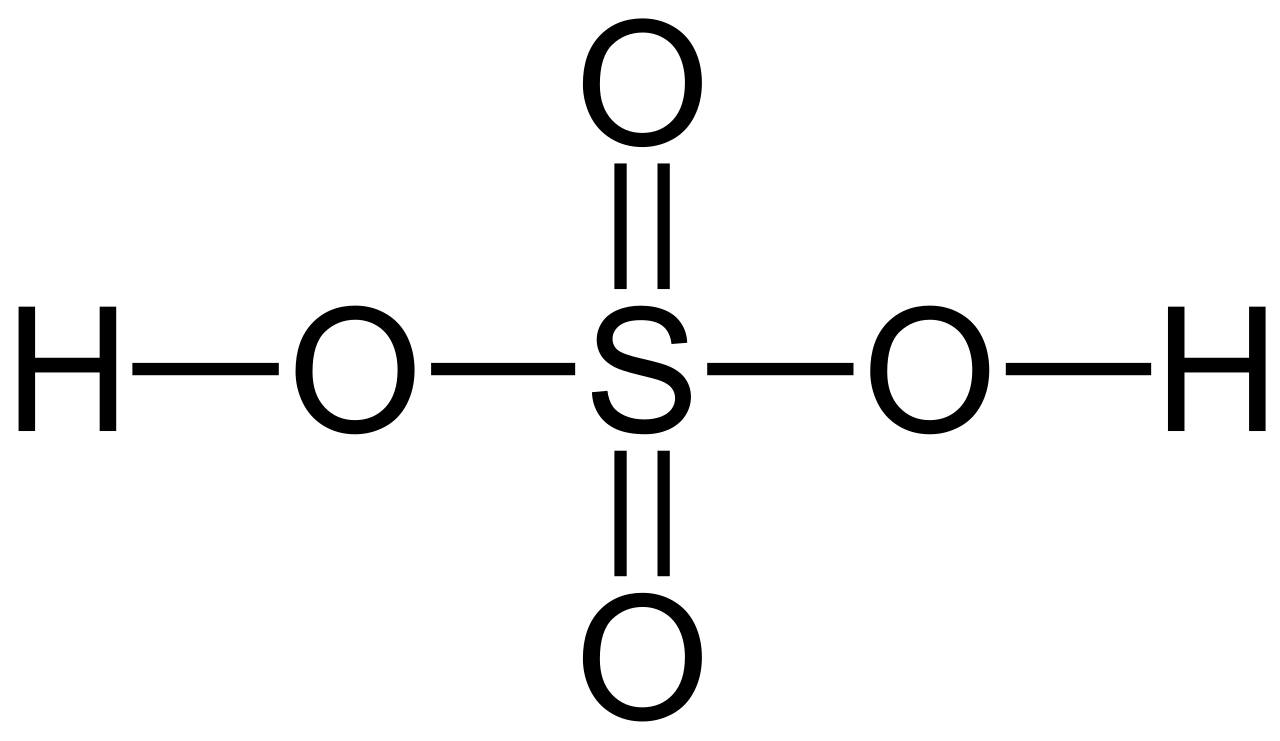
2 Fe + 3 H2SO4 → Fe2(SO4)3 + 3 SO2 + 4 H2O
Trong phản ứng này, Fe tác dụng với axit sulfuric (H2SO4) để tạo ra muối sunfat sắt (III) Fe2(SO4)3, trong đó Fe bị oxi hóa từ hình thức oxit sắt (II) lên oxit sắt (III). Đồng thời, H2SO4 bị khử thành SO2 và nước.
Fe có tác dụng với H2SO4 loãng không?
Fe (sắt) có thể tác dụng với H2SO4 loãng (axit sulfuric loãng), tạo ra ion sắt (II) và khí hydro:
Fe + H2SO4 (loãng) → FeSO4 + H2↑
Trong phản ứng này, axit sulfuric loãng bị khử thành khí hydro và sắt bị oxi hóa thành ion sắt (II) (Fe2+), còn sản phẩm là sắt sunfat (FeSO4).
Tuy nhiên, khi tác dụng với axit sulfuric đậm đặc, Fe sẽ không phản ứng được vì lớp óxit bảo vệ bề mặt sắt chống lại sự tác động của axit. Nếu muốn Fe tác dụng với axit sulfuric đậm đặc, ta cần thêm một chất oxy hóa như CuO (oxit đồng (II)) để phá vỡ lớp óxit trên bề mặt sắt và tạo điều kiện cho phản ứng xảy ra.
Fe có tác dụng với H2SO4 đặc nóng không?
Fe có thể tác dụng với H2SO4 đặc nóng, nhưng phản ứng sẽ là một phản ứng nguy hiểm và dễ gây cháy nổ.
Trong phản ứng Fe + H2SO4 đặc, nhiệt độ cao của axit đặc sẽ tác động lên cấu trúc của kim loại sắt, khiến cho sắt bị oxi hóa nhanh hơn và phản ứng sẽ diễn ra mạnh hơn. Phản ứng sẽ tạo ra khí hidro (H2) và muối sunfat sắt (II) FeSO4, cũng như khí SO2 nếu quá trình oxi hóa quá mạnh.
Tuy nhiên, phản ứng này cũng rất nguy hiểm vì có thể tạo ra lượng lớn khí H2 trong một thời gian ngắn, gây nguy hiểm cho sức khỏe và có thể dẫn đến cháy nổ. Do đó, việc thực hiện phản ứng Fe + H2SO4 đặc nóng cần phải được thực hiện cẩn thận và dưới sự giám sát của các chuyên gia hoặc những người có kinh nghiệm trong lĩnh vực này.
Fe có tác dụng với H2SO4 đặc nguội không?
Sắt (Fe) không tác dụng với H2SO4 đặc nguội, hay còn gọi là H2SO4 đậm đặc, do có tính chất oxi hóa mạnh, tạo ra lớp bảo vệ bề mặt trên sắt. Lớp bảo vệ này ngăn chặn phản ứng giữa sắt và axit sulfuric.
Tuy nhiên, nếu đưa sắt vào H2SO4 đặc nguội và tăng nhiệt độ, lớp bảo vệ sẽ bị phá hủy, sắt bị oxi hóa và phản ứng xảy ra. Khi đó, phản ứng giữa Fe và H2SO4 đặc nguội sẽ tạo ra SO2, Fe2(SO4)3 và H2O:
Fe + H2SO4 (đặc) → Fe2(SO4)3 + SO2 + H2O
Để thúc đẩy phản ứng trên, thường cần phải dùng chất xúc tác như Cu (đồng) hoặc Pt (bạch kim).
Cách thực hiện phản ứng hóa học Fe + H2SO4
Khi thực hiện phản ứng hóa học giữa Fe và H2SO4, cần phải tuân theo các quy tắc an toàn để tránh tai nạn và nguy hiểm cho sức khỏe. Sau đây là hướng dẫn cơ bản để thực hiện phản ứng Fe + H2SO4:
Các vật dụng cần chuẩn bị:
- Kim loại sắt (Fe): có thể sử dụng miếng sắt dạng lá, sợi, dây hoặc bột sắt
- Axit sulfuric (H2SO4): phải sử dụng axit H2SO4 đặc có nồng độ cao hơn 95%
- Bình tách hoặc bình đựng axit: cần chọn loại bình chịu được axit và có độ dày đủ để tránh cháy nổ
- Nắp bình: để đậy kín bình chứa axit khi phản ứng diễn ra
- Kính chắn: để che phủ bình chứa axit và giảm thiểu tác động của khí độc
- Bình chứa nước: để rửa tay và làm mát trong trường hợp cần thiết
Găng tay, kính bảo hộ, khẩu trang: để bảo vệ cơ thể khỏi axit và khí độc
Cách thực hiện:
- Chuẩn bị bình tách và cho axit sulfuric vào. Lưu ý phải đeo kính bảo hộ và khẩu trang, và chú ý tránh tiếp xúc với axit.
- Thêm từ từ kim loại sắt vào bình chứa axit sulfuric. Lưu ý là phản ứng sẽ diễn ra mạnh và tạo ra khí hidro (H2) và muối sunfat sắt (II) FeSO4, cũng như khí SO2 nếu quá trình oxi hóa quá mạnh. Do đó cần chú ý đến việc đậy kín nắp bình và sử dụng kính chắn để giảm thiểu tác động của khí độc.
- Khi phản ứng kết thúc, châm nước vào bình chứa để làm mát và rửa tay.
Lưu ý: Phản ứng giữa Fe và H2SO4 là một phản ứng nguy hiểm và có thể dẫn đến cháy nổ nếu không thực hiện đúng cách. Do đó, việc thực hiện phản ứng này cần được thực hiện cẩn thận và dưới sự giám sát của các chuyên gia hoặc những người có kinh nghiệm trong lĩnh vực thí nghiệm.
Fe + H2SO4 hiện tượng hóa học
Phản ứng giữa sắt (Fe) và axit sulfuric (H2SO4) là một phản ứng oxi-hoá khử. Phản ứng này sẽ tạo ra sản phẩm sắt sunfat (FeSO4) và khí hydro (H2).
Phản ứng được miêu tả bằng phương trình hóa học sau đây:
Fe + H2SO4 → FeSO4 + H2
Trong phản ứng trên, sắt bị oxi hóa từ trạng thái không tải (Fe) thành trạng thái ion sắt (II) (Fe2+). Cùng lúc đó, axit sulfuric bị khử thành khí hydro (H2). Sản phẩm của phản ứng là sắt sunfat (FeSO4) và khí hydro (H2).
Trong quá trình phản ứng, có thể quan sát được hiện tượng nhiệt phát ra do phản ứng là phản ứng phát nhiệt. Ngoài ra, cũng có thể quan sát thấy khí hydro bay ra từ dung dịch phản ứng. Nếu dung dịch phản ứng cô đặc, ta có thể thấy được tinh thể sắt sunfat (FeSO4) tạo thành.
Cân bằng phản ứng oxi hóa khử Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Cân bằng pt Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O điều kiện loãng
Để cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O trong điều kiện loãng, ta cần thực hiện các bước sau đây:
+ Bước 1: Viết công thức hóa học của tất cả các chất trong phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
+ Bước 2: Xác định số nguyên tố và số phân tử của các chất trong phương trình:
Fe: 1 nguyên tố
H: 2 nguyên tố
S: 1 nguyên tố
O: 10 nguyên tố
SO2: 1 phân tử
H2O: 1 phân tử
+ Bước 3: Cân bằng số nguyên tố của các chất trên cả hai phía của phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
1 1 1 1 1
+ Bước 4: Cân bằng số phân tử của các chất trên cả hai phía của phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
1 1 1 1 1
1 3 1 1 2
+ Bước 5: Kiểm tra lại phương trình đã cân bằng:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Với phương trình đã cân bằng, ta có 1 nguyên tố Fe, 3 nguyên tố H, 1 nguyên tố S và 10 nguyên tố O trên cả hai phía của phương trình. Phản ứng này diễn ra trong điều kiện loãng, nghĩa là H2SO4 có nồng độ thấp hơn so với điều kiện đặc nóng, do đó phản ứng sẽ không quá mạnh và chỉ tạo ra một lượng nhỏ khí SO2.
Cân bằng pt Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O điều kiện đặc nóng
Phương trình hóa học cho phản ứng giữa sắt (Fe) và axit sulfuric (H2SO4) đặc nóng đã được cân bằng như sau:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Để cân bằng phương trình này, ta cần tạo ra 2 ion Fe trên cả hai vế của phương trình. Do đó, ta sẽ cân bằng phương trình theo các bước sau:
+ Bước 1: Cân bằng số lượng nguyên tử sắt trên cả hai vế bằng cách thêm hệ số 2 phía trước FeSO4 ở vế phải:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
+ Bước 2: Cân bằng số lượng nguyên tử oxi trên cả hai vế bằng cách thêm hệ số 3 phía trước H2O ở vế phải:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + 3H2O
+ Bước 3: Cân bằng số lượng nguyên tử lưu huỳnh trên cả hai vế bằng cách thêm hệ số 3 phía trước SO2 ở vế phải:
Fe + H2SO4 → Fe2(SO4)3 + 3SO2 + 3H2O
Vậy phương trình hóa học đã được cân bằng:
Fe + H2SO4 → Fe2(SO4)3 + 3SO2 + 3H2O
Lưu ý rằng phản ứng này chỉ xảy ra ở điều kiện đặc nóng, khi sử dụng axit sulfuric đậm đặc và tăng nhiệt độ để phá hủy lớp bảo vệ bề mặt trên sắt.
Cân bằng pt Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O điều kiện đặc nguội
Để cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O trong điều kiện đặc nguội, ta cần thực hiện các bước sau đây:
+ Bước 1: Viết công thức hóa học của tất cả các chất trong phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
+ Bước 2: Xác định số nguyên tố và số phân tử của các chất trong phương trình:
Fe: 1 nguyên tố
H: 2 nguyên tố
S: 1 nguyên tố
O: 10 nguyên tố
SO2: 1 phân tử
H2O: 1 phân tử
+ Bước 3: Cân bằng số nguyên tố của các chất trên cả hai phía của phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
1 1 2 1 0
+ Bước 4: Cân bằng số phân tử của các chất trên cả hai phía của phương trình:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
1 1 1 1 2
+ Bước 5: Kiểm tra lại phương trình đã cân bằng:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Với phương trình đã cân bằng, ta có 1 nguyên tố Fe, 2 nguyên tố H, 1 nguyên tố S và 10 nguyên tố O trên cả hai phía của phương trình. Phản ứng này diễn ra trong điều kiện đặc nguội, nghĩa là H2SO4 được đun nóng và cô cạn cho đến khi thể tích giảm đi đáng kể, do đó phản ứng sẽ mạnh hơn so với điều kiện loãng và tạo ra một lượng lớn khí SO2
Cân bằng pt Fe + H2SO4 loãng dư
Phương trình hóa học cho phản ứng giữa sắt (Fe) và axit sulfuric (H2SO4) loãng dư chưa được cân bằng. Phản ứng này có thể xảy ra như sau:
Fe + H2SO4 → FeSO4 + SO2 + H2O
Tuy nhiên, phương trình trên chưa được cân bằng về số lượng nguyên tử của các nguyên tố. Để cân bằng phương trình này, ta cần thêm các hệ số phù hợp vào trước các chất tham gia và sản phẩm.
Các bước cân bằng phương trình như sau:
+ Bước 1: Cân bằng số nguyên tử Sắt (Fe) bằng cách thêm hệ số 1 phía trước FeSO4 ở vế phải:
Fe + H2SO4 → FeSO4 + SO2 + H2O
+ Bước 2: Cân bằng số nguyên tử Hidro (H) bằng cách thêm hệ số 2 phía trước H2O ở vế phải:
Fe + H2SO4 → FeSO4 + SO2 + 2H2O
+ Bước 3: Cân bằng số nguyên tử Lưu huỳnh (S) bằng cách thêm hệ số 1 phía trước SO2 ở vế trái:
Fe + H2SO4 → FeSO4 + H2O + SO2
Vậy phương trình đã được cân bằng:
Fe + H2SO4 → FeSO4 + H2O + SO2
Lưu ý rằng trong phản ứng này, axit sulfuric (H2SO4) được cho là “loãng dư”, tức là lượng axit được sử dụng nhiều hơn lượng sắt trong phản ứng.
Ví dụ bài tập về pt Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Bài tập: Cho 16,8 gam sắt tác dụng với dung dịch H2SO4 đặc nóng dư thu được 31,2 gam hỗn hợp khí X (bao gồm SO2 và H2O) và dung dịch Y. Hãy viết phương trình hoá học và tính khối lượng của dung dịch Y thu được.
Giải quyết:
+ Bước 1: Viết phương trình hoá học:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
+ Bước 2: Tính số mol sắt (Fe) trong phản ứng:
n(Fe) = m/ M = 16.8/56 = 0.3 mol
+ Bước 3: Tính số mol H2SO4 sử dụng: Theo phương trình hoá học, số mol H2SO4 sử dụng bằng số mol Fe, do đó n(H2SO4) = 0.3 mol
+ Bước 4: Tính số mol sản phẩm SO2: Theo phương trình hoá học, số mol SO2 sản xuất bằng 1/2 số mol H2SO4 sử dụng, nên:
n(SO2) = 1/2 x 0.3 mol = 0.15 mol
+ Bước 5: Tính khối lượng khí SO2 thu được: Theo định luật khí nén của Avogadro, 1 mol khí ở đktc có thể chiếm một thể tích bằng 22.4 lít.
Vậy, thể tích của khí SO2 thu được là: V(SO2) = n(SO2) x 22.4 = 0.15 x 22.4 = 3.36 lít
Theo định luật trạng thái khí Ideal, khí ở đktc có khối lượng riêng bằng 1.293 g/lít. Vậy, khối lượng của khí SO2 thu được là: m(SO2) = V(SO2) x ρ(SO2) = 3.36 x 1.293 = 4.34 g
+ Bước 6: Tính khối lượng dung dịch Y thu được:
Theo định luật bảo toàn khối lượng, khối lượng của dung dịch Y thu được bằng khối lượng ban đầu của sắt trừ đi khối lượng hỗn hợp khí X thu được, do đó:
m(Y) = m(Fe) – m(X) = 16.8 – 31.2 = -14.4 g
Kết quả này là không thực tế, có thể do sai số trong quá trình đo lường. Tuy nhiên, ta có thể kết luận rằng khối lượng của dung dịch Y thu được là âm, cho thấy quá trình tính toán có sai sót.
Các dạng bài tập về Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Dưới đây là một số dạng bài tập liên quan đến phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O:
- Viết phương trình hóa học cho phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O.
- Cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O trong điều kiện loãng.
- Cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O trong điều kiện đặc nguội.
- Tính khối lượng Fe cần dùng để tác dụng hoàn toàn với 20 mL dung dịch H2SO4 1M.
- Cho 4,48 gam Fe tác dụng với dung dịch H2SO4 đặc 96%, thu được dung dịch X và 2,24 lít khí SO2 (đktc). Xác định nồng độ % của dung dịch H2SO4.
- Cho 3,2 gam hỗn hợp Fe và Fe2O3 tác dụng với dung dịch H2SO4 đặc dư, thu được 1,792 lít khí SO2 (đktc) và dung dịch Y. Tính nồng độ mol của dung dịch Y.
- Cho 4,02 gam hỗn hợp gồm Fe và Mg tác dụng với dung dịch H2SO4 đặc dư, thu được dung dịch Z và 2,24 lít khí SO2 (đktc). Cho dung dịch NaOH dư vào Z, thu được 7,68 gam kết tủa. Tính tỷ lệ mol Fe:Mg trong hỗn hợp ban đầu.
- Tính thể tích dung dịch H2SO4 đặc 98% cần dùng để cô cạn hoàn toàn 20 gam dung dịch H2SO4 0,2M.
- Dung dịch X chứa FeSO4 0,01M và H2SO4 0,1M. Tính thể tích dung dịch X cần dùng để tác dụng hoàn toàn với 5,6 gam Fe.
- Cho 5,6 gam Fe tác dụng với dung dịch H2SO4 đặc dư. Thu được 2,24 lít khí SO2 (đktc) và dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được 10,24 gam kết tủa. Tính nồng độ mol của dung dịch H2SO4.
Cách học thuộc phản ứng Fe + H2SO4
Để học thuộc phản ứng hóa học Fe + H2SO4, bạn có thể thực hiện các bước sau:
- Đọc và hiểu công thức hóa học của các chất tham gia và sản phẩm trong phản ứng. Trong trường hợp này, Fe là ký hiệu hoá học của sắt, H2SO4 là ký hiệu hoá học của axit sulfuric, Fe2(SO4)3 là ký hiệu hoá học của sunfat sắt(III), SO2 là ký hiệu hoá học của khí lưu huỳnh dioxide và H2O là ký hiệu hoá học của nước.
- Quan sát phản ứng trực tiếp nếu có thể hoặc tìm hiểu thông qua các nguồn tài liệu khác như sách giáo khoa, sách tham khảo, trang web chuyên ngành, video giảng dạy, v.v.
- Lặp lại việc viết công thức hóa học và cân bằng phương trình hóa học cho phản ứng một số lần để ghi nhớ.
- Sử dụng các phương pháp học thuộc khác nhau như ghi chú, viết lại nhiều lần, làm các bài tập liên quan, sử dụng các phương tiện học tập khác như flashcard, ứng dụng học tập trên điện thoại, v.v.
- Làm quen với cách sử dụng phản ứng hóa học trong các bài tập và vấn đề thực tế để cải thiện khả năng áp dụng và ứng dụng kiến thức.
- Học cách liên kết phản ứng hóa học này với các phản ứng khác để hiểu được sự tương quan và ứng dụng của kiến thức này trong thực tế.
Lưu ý rằng việc học thuộc phản ứng hóa học không chỉ đòi hỏi sự khả năng tư duy và ghi nhớ của bạn mà còn yêu cầu sự kiên trì và thường xuyên luyện tập.
Mẹo làm bài tập Fe + H2SO4 đạt điểm cao
Để làm bài tập về phản ứng Fe + H2SO4 đạt điểm cao, bạn có thể thực hiện các bước sau:
- Đọc đề bài và đề phòng những điều kiện đặc biệt nào có thể được đề cập.
- Xác định các chất tham gia và sản phẩm trong phản ứng.
- Viết phương trình hóa học cho phản ứng và cân bằng phương trình hóa học nếu cần thiết. Đảm bảo viết đúng các ký hiệu hoá học và bảo toàn số nguyên tố trong phản ứng.
- Tính toán khối lượng hoặc thể tích của các chất tham gia và sản phẩm. Đảm bảo đơn vị đo lường được sử dụng đồng nhất và đúng.
- Xác định loại phản ứng hóa học (điều chế, thủy phân, oxi hóa khử, v.v.) và điều kiện phản ứng (nhiệt độ, áp suất, pH, v.v.) để giải quyết bài tập.
- Làm các bước tính toán cần thiết để tìm ra đáp án. Đảm bảo độ chính xác và độ chính xác phù hợp với yêu cầu của đề bài.
- Kiểm tra lại kết quả để đảm bảo tính hợp lý và đúng đắn.
Lưu ý rằng để đạt điểm cao trong các bài tập về phản ứng Fe + H2SO4, bạn cần phải hiểu rõ kiến thức về hóa học và áp dụng chúng một cách chính xác. Bên cạnh đó, bạn nên luyện tập thường xuyên và đọc thêm các tài liệu liên quan để nâng cao khả năng giải quyết các bài tập về phản ứng hóa học.
Ứng dụng phản ứng Fe + H2SO4 vào đời sống
Phản ứng giữa sắt (Fe) và axit sunfuric (H2SO4) là một phản ứng hóa học quan trọng trong đời sống và công nghiệp. Dưới đây là một số ứng dụng của phản ứng này:
- Tẩy gỉ sắt: Sắt thường bị ăn mòn bởi các chất oxy hóa, do đó việc loại bỏ gỉ trên bề mặt sắt là rất quan trọng để tăng tuổi thọ và độ bền của vật liệu sắt. Phản ứng của sắt với axit sunfuric là một trong những cách hiệu quả để loại bỏ gỉ trên bề mặt sắt.
- Sản xuất sulfat sắt: Phản ứng giữa sắt và axit sunfuric đặc có thể được sử dụng để sản xuất sulfat sắt (FeSO4), một hợp chất hóa học được sử dụng trong sản xuất thuốc, phân bón, chất bảo quản thực phẩm và sản xuất mực in.
- Sản xuất khí hidro sulfua (H2S): Trong phòng thí nghiệm, phản ứng giữa sắt và axit sunfuric được sử dụng để sản xuất khí hidro sulfua (H2S), một khí độc có mùi khai.
- Sản xuất nước có cồn: Trong quá trình sản xuất nước có cồn, phản ứng giữa axit sunfuric và đường glucose tạo ra khí metan và nước.
- Xử lý nước thải: Phản ứng giữa axit sunfuric và các chất hữu cơ trong nước thải có thể được sử dụng để loại bỏ các chất ô nhiễm khác nhau, như các muối kim loại và các hợp chất hữu cơ. Tuy nhiên, việc sử dụng phản ứng này phải được thực hiện cẩn thận để đảm bảo an toàn và không gây hại cho môi trường.
Tài liệu dạy bài Fe + H2SO4
Dưới đây là một số tài liệu dạy bài về phản ứng Fe + H2SO4:
- “Hóa học 11” – Tập 1 (Nguyễn Hữu Đại, 2018): Đây là một trong những tài liệu được sử dụng rộng rãi trong giáo dục phổ thông tại Việt Nam. Nó cung cấp các kiến thức cơ bản về phản ứng Fe + H2SO4, bao gồm định nghĩa, phương trình phản ứng và tính chất của các chất tham gia và sản phẩm.
- “Bài giảng Hóa học 11 – Bài 5: Oxi hóa khử” (Phạm Văn Minh, 2019): Bài giảng này cung cấp một cách tiếp cận đơn giản và dễ hiểu về phản ứng Fe + H2SO4. Nó bao gồm các nội dung về quá trình oxi hóa khử, cách cân bằng phương trình hóa học và tính toán các giá trị liên quan đến phản ứng.
- “Hóa học 12” – Tập 1 (Nguyễn Văn Ngọc, 2020): Đây là một tài liệu dành cho học sinh lớp 12, nó cung cấp các kiến thức nâng cao về phản ứng Fe + H2SO4. Nó bao gồm các nội dung về tính chất của các chất tham gia và sản phẩm, cách xác định loại phản ứng, cách cân bằng phương trình hóa học và tính toán các giá trị liên quan đến phản ứng.
- “Hóa học ứng dụng” (Tạ Thị Thanh Thúy, 2019): Đây là một tài liệu chuyên sâu về ứng dụng của phản ứng Fe + H2SO4 trong sản xuất xi mạ. Nó cung cấp thông tin về quy trình sản xuất, cách tính toán các giá trị liên quan đến quá trình sản xuất, và các ứng dụng khác của phản ứng này.
Ngoài ra, bạn có thể tìm thêm các tài liệu khác trên các trang web giáo dục hoặc các trang web chuyên về hóa học như ChemLib, ChemEdX, hoặc các trang web của các trường đại học chuyên ngành.
Trên đây là tất cả các thông tin liên quan đến phản ứng hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O mà mọi người có thể tham khảo. Hi vọng với những thông tin vừa chia sẻ, mọi người sẽ biết cách cân bằng phản ứng Fe + H2SO4 dưới nhiều điều kiện cũng như nắm được hiện tượng hóa học khi cho Fe tác dụng với H2SO4.