Một trong những phản ứng oxi hóa quan trọng trong hóa học là phản ứng giữa phenol và axit nitric (HNO3) trong điều kiện xúc tác của H2SO4. Phản ứng này tạo ra một sản phẩm chính là 2,4,6-trinitrophenol hay còn gọi là picric acid. Picric acid có nhiều ứng dụng như trong lĩnh vực phân tích hoá học, bảo vệ thực vật, và trong sản xuất thuốc nhuộm. Trong bài viết này, chúng ta sẽ cùng Dapanchuan.com tìm hiểu rõ hơn về phản ứng C6H5OH + hno3.
C6H5OH + HNO3 (đặc loãng) xúc tác h2so4 là gì?
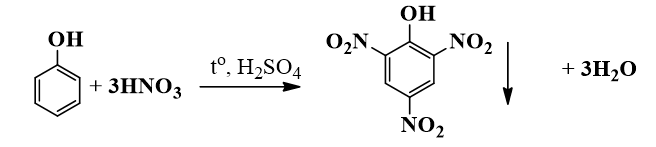
Phenol (C6H5OH) phản ứng với axit nitric (HNO3) trong điều kiện axit để tạo thành sản phẩm chính là 2,4,6-trinitrophenol (hay còn gọi là picric acid) và nước:
C6H5OH + 3 HNO3 → C6H2(NO2)3OH + 3 H2O
Phản ứng này được gọi là phản ứng nitro hóa. Sản phẩm 2,4,6-trinitrophenol là một hợp chất rất dễ nổ, thường được sử dụng trong các mũi đạn và thuốc nổ.
Tính chất hóa học của C6H5OH (Phenol)
Trước khi tìm hiểu rõ hơn về phương trình phản ứng của C6H5OH + HNO3, chúng ta có thể tìm hiểu sơ qua về tính chất hóa học của hợp chất chính trong phương trình là C6H5OH:
- Tính axit: Phenol có tính axit yếu, do có khả năng nhường proton từ nhóm hydroxy (OH) của mình cho một chất bazơ. Điều này làm cho phenol có thể tác dụng với các chất bazơ, như natri hydroxide (NaOH), để tạo ra muối phenol, chẳng hạn như natri phenolat (C6H5ONa).
- Tính oxi hóa: Phenol có thể bị oxi hóa dễ dàng để tạo ra các hợp chất nitro hoặc quinon. Chẳng hạn, khi phenol phản ứng với axit nitric trong môi trường acid, ta có thể tạo ra 2,4,6-trinitrophenol, còn được gọi là picric acid.
- Tính khử: Phenol có thể tác dụng như một chất khử trong một số phản ứng hóa học. Chẳng hạn, nó có thể khử các ion permanganat (MnO4-) để tạo ra ion mangan (Mn2+) và nước.
- Tính trung hòa: Phenol có tính trung hòa, do có khả năng tạo liên kết hydro với các phân tử nước. Điều này làm cho phenol có tính chất tan trong nước tốt hơn so với các benzen đơn chức khác.
- Tính đa chức: Phenol có nhiều điểm tác dụng trên phân tử của nó, bao gồm các nhóm hydroxy và nhóm thơm. Điều này làm cho phenol có khả năng tạo ra nhiều hợp chất dẫn xuất, chẳng hạn như các este, este sunfat, amin và các hợp chất halogen.
Cân bằng phương trình Phenol + HNO3 xúc tác H2SO4
Phương trình hóa học cho phản ứng giữa phenol (C6H5OH) và axit nitric (HNO3) là:
C6H5OH + HNO3 → C6H2(NO2)3OH + H2O
Để cân bằng phương trình này, ta thêm hệ số tỉ lệ để số nguyên tử của mỗi nguyên tố là bằng nhau giữa các hạt chất tham gia và sản phẩm:
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Vậy phương trình đã được cân bằng.
Điều kiện để xảy ra phản ứng C6H5OH + hno3
– Phản ứng giữa phenol (C6H5OH) và axit nitric (HNO3) để tạo ra picric acid (C6H2(NO2)3OH) và nước (H2O) là một phản ứng nitro hóa. Để phản ứng này xảy ra, cần có điều kiện:
+ Có sự có mặt của acid sulfuric (H2SO4) dùng để tác nhân nitrating (NO2+) được tạo ra từ HNO3. H2SO4 còn giúp cho phản ứng nhanh hơn bằng cách tạo môi trường axit và tách nước (H2O) ra khỏi phản ứng.
+ Nhiệt độ của hỗn hợp phản ứng cần được duy trì trong khoảng từ 50 đến 60 độ C để tăng tốc độ phản ứng.
+ Phản ứng nitro hóa chỉ xảy ra với các hợp chất có nhóm -OH hoặc -NH2 đính kèm trực tiếp vào vòng benzen của hợp chất hữu cơ. Do đó, điều kiện cuối cùng để phản ứng xảy ra là có mặt của phenol (C6H5OH) và axit nitric (HNO3) trong điều kiện axit và có acid sulfuric (H2SO4) để tác nhân nitrating (NO2+) được tạo ra.
Hiện tượng của phản ứng C6H5OH + hno3
Phản ứng giữa phenol (C6H5OH) và axit nitric (HNO3) là một phản ứng oxi hóa mạnh, trong đó một phân tử phenol tác dụng với một phân tử axit nitric để tạo ra sản phẩm chính là 2,4,6-trinitrophenol, hay còn gọi là picric acid (C6H2(NO2)3OH), cùng với một phân tử nước (H2O) được thải ra.
Trong quá trình phản ứng, nguyên tử nitro (NO2) được liên kết với các vị trí ortho và para của nhân phenol, để tạo thành sản phẩm picric acid. Trong khi đó, nguyên tử hydro trong axit nitric sẽ tham gia liên kết với nguyên tử hydroxyl (-OH) trong phenol để tạo ra phân tử nước.
Phản ứng này thường được thực hiện trong điều kiện đặc loãng của axit nitric và xúc tác bởi axit sulfuric (H2SO4), để tạo ra điều kiện phản ứng thuận lợi và đạt hiệu suất cao. Tùy vào điều kiện phản ứng, sản phẩm có thể được tạo ra với các tỉ lệ khác nhau, nhưng picric acid là sản phẩm chính và được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau của hóa học.
Bản chất của các chất tham gia vào phản ứng C6H5OH + hno3
Trong phản ứng C6H5OH + HNO3, các chất tham gia phản ứng có các bản chất như sau:
- C6H5OH: Là phenol, một hợp chất hữu cơ có công thức phân tử là C6H5OH. Nó là một chất lỏng không màu, có mùi đặc trưng, dễ tan trong nước và dung môi hữu cơ khác. Phenol có tính axit yếu và được sử dụng trong nhiều ứng dụng công nghiệp và y tế.
- HNO3: Là axit nitric, một axit vô cơ có công thức phân tử là HNO3. Nó là một chất lỏng màu vàng nhạt, có tính ăn mòn mạnh và dễ phân hủy trong ánh sáng. Axit nitric được sử dụng trong sản xuất phân bón, thuốc nhuộm, thuốc nổ và trong các ứng dụng hóa học khác.
- H2SO4: Là axit sulfuric, một axit vô cơ mạnh có công thức phân tử là H2SO4. Nó là một chất lỏng màu trắng trong suốt, có tính ăn mòn mạnh và là một trong những hóa chất quan trọng nhất trong công nghiệp. Axit sulfuric được sử dụng trong sản xuất pin, thuốc nhuộm, thuốc nổ và trong các ứng dụng hóa học khác.
Các bài tập vận dụng liên quan đến C6H5OH + hno3
1. Tính khối lượng chất bị oxy hóa:
Giả sử ta cho 10g phenol và 10g HNO3 tác dụng với nhau. Sử dụng phương trình phản ứng và các khối lượng phân tử tương ứng, ta có:
C6H5OH + HNO3 → C6H2(NO2)3OH + H2O
Khối lượng phân tử của phenol = 94 g/mol
Khối lượng phân tử của HNO3 = 63 g/mol
Khối lượng phân tử của C6H2(NO2)3OH = 229 g/mol
Khối lượng phân tử của nước = 18 g/mol
Số mol của phenol = 10g / 94 g/mol = 0.106 mol
Số mol của HNO3 = 10g / 63 g/mol = 0.158 mol
Từ phương trình phản ứng, ta thấy 1 mol phenol phản ứng với 1 mol HNO3, vì vậy số mol của chất bị oxy hóa (C6H5OH + HNO3) sẽ bằng số mol của chất hóa học nào ít hơn, tức là 0.106 mol.
Số mol của sản phẩm (C6H2(NO2)3OH + H2O) cũng bằng 0.106 mol.
Khối lượng của sản phẩm C6H2(NO2)3OH là:
0.106 mol x 229 g/mol = 24.374 g
Khối lượng của nước là:
0.106 mol x 18 g/mol = 1.908 g
Vì vậy, sau phản ứng, ta sẽ thu được 24.374 g C6H2(NO2)3OH và 1.908 g H2O.
2. Xác định số mol của các chất tham gia và sản phẩm:
Số mol của phenol và HNO3 đã được tính ở phần trước:
Số mol của phenol = 0.106 mol
Số mol của HNO3 = 0.158 mol
Số mol của sản phẩm sẽ bằng số mol của chất bị oxy hóa, tức là 0.106 mol.
Số mol của C6H2(NO2)3OH sẽ là 0.106 mol, và số mol của nước sẽ là 0.106 mol.
3. Tính số mol H2SO4 cần dùng trong quá trình xúc tác:
Phương trình phản ứng cho biết rằng xúc tác H2SO4 được sử dụng để tạo điều kiện cho phản ứng xảy ra. Vậy số mol H2SO4 cần dùng để xúc tác phản ứng này là bao nhiêu?
Khối lượng phân tử của H2SO4 = 98 g/mol
Với phản ứng này, ta cần dùng H2SO4 đặc loãng, vì vậy nồng độ của H2SO4 không được cung cấp. Tuy nhiên, ta có thể giả định rằng lượng H2SO4 dùng là không đổi trong quá trình xúc tác.
Theo phương trình phản ứng, ta biết rằng 1 mol H2SO4 phản ứng với 1 mol HNO3. Vì vậy, số mol H2SO4 cần dùng để xúc tác với 0.158 mol HNO3 là 0.158 mol.
5. Tính khối lượng H2SO4 cần dùng trong quá trình xúc tác:
Số mol H2SO4 cần dùng là 0.158 mol.
Khối lượng H2SO4 tương ứng là:
0.158 mol x 98 g/mol = 15.484 g
Vậy ta cần dùng khoảng 15.484 g H2SO4 để xúc tác với 10 g phenol và 10 g HNO3.
Nếu bạn quan tâm đến lĩnh vực hóa học, đặc biệt là về phản ứng oxi hóa. Bài viết trên đã cung cấp những thông tin hữu ích về phương trình C6H5OH + hno3 cho mọi người tìm hiểu. Hy vọng mọi người đã tìm thấy thông tin hóa học hữu ích và đáp ứng nhu cầu của mình.