Cân bằng hóa học là một trong những bài tập khi học môn hóa chúng ta sẽ luôn sẽ gặp đến. Và bài tập ngày hôm nay của chúng ta sẽ cân bằng phương trình Al + HNO3 = Al(NO33 + NH4NO3 +H2O đặc & loãng. Vậy thì phương trình này sẽ cân bằng như thế nào? chúng ta hãy cùng nhau giải bài tập này các bạn nhé. Trước tiên chúng ta hãy ôn lại một số cách để cân bằng phương trình hóa học nhé.

Cách cân bằng Phương trình Hóa học
Đối với bộ môn Hóa học thì việc phải cân bằng những phương trình luôn là nỗi ám ảnh của các bạn học sinh. Nhưng thực ra việc cân bằng những phương trình hóa học này thật rất là đơn giản. Tuy nhiên, có những phương trình mà ở đó nhiều chất tham gia phản ứng và cho ra nhiều sản phẩm làm cho các bạn học sinh khi gặp phải đề khó sẽ bị rối không thể cân bằng được phương trình. Dưới đây là một số những phương pháp cân bằng phương trình giúp các bạn học sinhcó thể làm được những bài tập cân bằng phương trình hóa học một cách dễ dàng, nhanh chóng và chính xác nhất.
Trước hết các bạn học sinh cần ghi nhớ trình tự cân bằng một phương trình Hóa học:
Bước thứ 1: cân bằng nhóm nguyên tử (OH, NO3, SO4, CO2, PO4..)
Bước thứ 2: cân bằng nguyên tử Hidro
Bước thứ 3: cân bằng nguyên tử Oxi
Bước thứ 4: cân bằng các nguyên tố còn lại.
Cân bằng theo trình tự Kim loại – Phi kim
Cân bằng phương trình hóa học theo trình tự Kim loại – Phi kim có nghĩa là chúng ta sẽ cân bằng theo trình tự cân bằng số nguyên tử của kim loại trước rồi tới phi kim, sau đó tới Hidro và tới oxi.
Vd: CuFeS2 + O2 -> CuO + Fe2O3 + SO2
Do nguyên tử Cu đã cân bằng nên thứ tự cân bằng đầu tiên sẽ là: Fe sau đó sẽ là Cu, S, O rồi nhân đôi các hệ số ta có kết quả là:
4CuFeS2 + 13O2 = 4CuO + 2 Fe2O3 + 8SO2
Phương pháp cân bằng phương trình chẵn lẻ
Đây là một trong những cách thức có thể cân bằng phương trình hóa học dễ dàng và nhanh chóng được sử dụng phổ biến. Với phương pháp này các bạn học sinh có thể sử dụng phương pháp chẵn lẻ, được áp dụng như sau:
- Khi mà một phương trình phản ứng đã cân bằng có nghĩa là số nguyên tử của nguyên tố ở vế phải sẽ bằng với số nguyên tử của nguyên tố ở vế trái, đồng nghĩa là số nguyên tử của một nguyên tố ở vế trái chẵn thì số nguyên tử của nguyên tố đó ở vế phải cũng phải chẵn.
- Cho nên nếu trong phương trình mà nếu một trong số những số nguyên tử của bất kỳ nguyên tố nào còn lẻ thì phải nhân đôi.
Vd: Ta lấy lại ví dụ ở trên: Fe + O2 -> Fe2O3
Vế trái số nguyên tử của Fe lẻ còn bên phải thì chẵn nên ta nhân Fe ở vế trái lên 2. Còn oxi ở vế trái thì chẵn, vế phải thì lẻ, nên ta cũng nhân 2 cho số nguyên tử oxi ở vế phải.
2Fe + O2 -> 2Fe2O3
Đến đây số nguyên tử của cả 2 bên đều đã chẵn, ta chỉ việc cân bằng lại cho sô nguyên tử của 2 bên bằng nhau.
4Fe + 3O2 = 2Fe2O3
Phương pháp từ nguyên tố chung nhất
Phương pháp từ nguyên tố chung nhất có nghĩa là nguyên tố nào có mặt trong hầu hết các hợp chất trong phương trình cần cân bằng thì chúng ta sẽ chọn để cân bằng hệ số các phân tử trước.
Vd: Cu + HNO3 -> Cu(NO3)2 + NO + H20
Trong phương trình này, nguyên tố Oxi xuất hiện nhiều nhất trong hầu hết các hợp chất nên sẽ cân bằng Oxi trước, rồi tới các nguyên tố khác.
Vế trái có 8 oxi, vế phải có 3 oxi. Vậy bội số chung nhỏ nhất của 8 và 3 là 24, suy ra hệ số của HNO3 là 24/3=8
Vậy phản ứng cân bằng là: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Phương pháp cân bằng phương trình bằng cách dùng hệ số thập phân
Phương pháp này áp dụng như sau: đặt hệ số vào các chất tham gia phản ứng, có thể là số nguyên tố hoặc là phân số miễn sao cho số nguyên tử ở cả hai vế đều bằng nhau. Sau đó nhân lên để khử mẫu số chung ở 2 vế.
Vd: Fe + O2 -> Fe2O3
Trước tiên ta thêm hệ số vào sẽ thành : 2Fe + 3/2O2 -> Fe2O3
Lúc này số nguyên tử ở 2 vế đã bằng nhau. Sau đó chúng ta nhân lên để khử mẫu, ở phương trình sẽ nhân lên cho 2.
Kết quả là: 4Fe + 3O2 = 2Fe2O3
Phương pháp cân bằng phương trình bằng đại số
Học sinh đặt hệ số a, b, c… lần lượt vào các công thức ở 2 vế của phương trình và thiết lập các phương trình toán học chứa các ẩn trên theo nguyên tắc số nguyên tử của nguyên tố trước và sau phản ứng bằng nhau. Bạn sẽ được 1 hệ phương trình chứa các ẩn, giải hệ phương trình này và đưa hệ số tương ứng tìm dược vào phương trình phản ứng và khử mẫu (nếu cần).
Với bài toán cân bằng phương trình hóa học FeS2 + O2 –> Fe2O3 + SO2, ta thấy, ở vế trái số nguyên tử O2 là chẵn với bất kỳ hệ số nào trong khi đó vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp các hệ số còn lại. 2Fe2O3 –> 4FeS2 –> 8SO2 + 11O2, thay vào PTPU ta được phương trình cân bằng là 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
Cân bằng phương trình Al+HNO3=Al(NO3)3+NH4NO3+H2O đặc & loãng
Cách giải:
- Điều kiện phản ứng Al tác dụng HNO3: Không có
- Cách tiến hành phản ứng cho Al tác dụng HNO3: Nhỏ từ từ dung dịch axit HNO3 vào ống nghiệm đã để sẵn lá nhôm (Al)
- Hiện tượng hóa học phản ứng cho Al tác dụng HNO3: Chất rắn màu trắng của nhôm (Al) tan dần trong dung dịch axit HNO3, xuất hiện hiện tượng sủi bọt khí trong dung dịch và hóa nâu ngoài không khí là nitơ oxit(NO)
Vậy ta có phương trình
Al (Nhôm ) + HNO3 ( Axit Nitric )→ Al(NO3)3 ( Nhôm Nitrat) + NH4NO3 ( Nitrat Amoni ) + H2O ( Nước)
PHƯƠNG TRÌNH HÓA HỌC
| Al | + HNO3 | → | Al(NO3)3 | + NH4NO3 | + 2H2O |
| Nhôm (rắn)(trắng bạc) | (dung dịch axit nitric)(không màu) | Nhôm nitrat (rắn) | amoni nitrat | (lỏng)(không màu) | |
| M = 8 | M = 30 | M = 8 | M = 3 | M = 9 |
Phương trình đã được cân bằng: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Bài tập trắc nghiệm về cân bằng phương trình
Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là:
A. 8, 3, 9
B. 2, 1, 4
C. 8, 3, 15
D. 2, 2, 5
Bài giải:
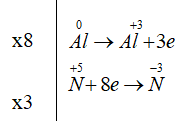
Hi vọng một số kiến thức mà chúng tôi mang đến bên trên này đã có thể giúp bạn Cân bằng phương trình Al+HNO3=Al(NO3)3+NH4NO3+H2O đặc & loãng rồi nhé. Chúc các bạn một ngày học tập vui vẻ.