H2SO4 loãng không tác dụng với chất nào? câu trả lời là: nó không tác dụng với một số chất như: kim loại kiềm và một số hydrocacbon không no. H2SO4 loãng là một chất axit quan trọng và được sử dụng rộng rãi trong nhiều lĩnh vực, từ công nghiệp cho đến đời sống. Trong bài viết này, hãy cùng Đáp Án Chuẩn tìm hiểu chi tiết về những chất không phản ứng với H2SO4 loãng và lý do tại sao chúng không tác dụng với nhau.
H2SO4 loãng là gì?
H2SO4 là công thức hóa học của axit sulfuric, một trong những axit mạnh nhất và phổ biến nhất trong hóa học. H2SO4 loãng là dung dịch axit sulfuric với nồng độ thấp hơn so với axit sulfuric nguyên chất.
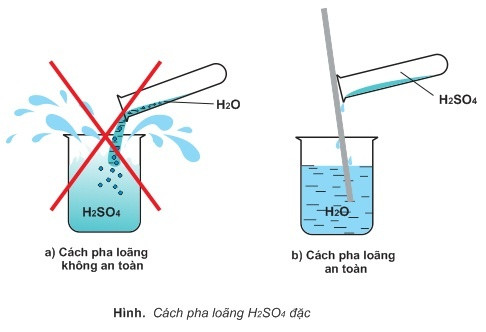
Để chuẩn bị dung dịch axit sulfuric loãng, ta cần pha trộn một lượng nhỏ axit sulfuric nguyên chất vào nước. Việc pha loãng axit sulfuric rất quan trọng để giảm độc tính của dung dịch và nguy cơ gây ăn mòn.
Tuy nhiên, khi pha loãng axit sulfuric, phải tuân thủ một số quy tắc an toàn như: luôn đổ axit vào nước chứ không phải ngược lại, đeo bảo hộ và sử dụng các thiết bị bảo vệ để tránh tiếp xúc trực tiếp với axit.
Các nồng độ axit sulfuric loãng khác nhau có thể được sử dụng cho các mục đích khác nhau, từ các ứng dụng trong phòng thí nghiệm đến sản xuất công nghiệp. Ví dụ, axit sulfuric loãng 10% được sử dụng trong thực phẩm và sản xuất dược phẩm, trong khi axit sulfuric loãng 30-50% được sử dụng trong sản xuất pin và bình điện.
Tính chất của H2SO4 loãng
Các tính chất của H2SO4 loãng bao gồm:
- Tính axit: H2SO4 loãng là một axit mạnh, có khả năng tác động mạnh lên kim loại, gây ra hiện tượng ăn mòn. Khi được pha loãng, tính axit của dung dịch giảm, nhưng vẫn là một axit mạnh.
- Tính ăn mòn: H2SO4 loãng có tính ăn mòn thấp hơn so với axit sulfuric nguyên chất, nhưng vẫn có khả năng gây ăn mòn. Do đó, cần phải tuân thủ các quy tắc an toàn khi làm việc với axit sulfuric loãng.
- Tính hút ẩm: H2SO4 loãng có khả năng hút ẩm cao, do đó nó thường được sử dụng trong các ứng dụng liên quan đến hấp thụ độ ẩm.
- Tính tan: H2SO4 loãng có khả năng tan được một số chất vô cơ như kim loại, oxit kim loại, hydroxide và muối. Việc này làm cho H2SO4 loãng trở thành một dung dịch quan trọng trong các ứng dụng liên quan đến hóa học và sản xuất.
- Tính tạo kết tủa: Khi H2SO4 loãng pha với một số dung dịch chứa ion, nó có khả năng tạo kết tủa như kết tủa sulfat, sulfat của kim loại, v.v.
Tóm lại, H2SO4 loãng là một dung dịch axit có tính chất phụ thuộc vào nồng độ và các điều kiện pha chế và sử dụng.
H2SO4 loãng không tác dụng với chất nào?
H2SO4 loãng là một dung dịch axit mạnh và có khả năng tác dụng với hầu hết các chất vô cơ và hữu cơ, do đó khó có trường hợp nào mà H2SO4 loãng không tác dụng với chất nào cả. Tuy nhiên, có một số chất khi tác dụng với H2SO4 loãng sẽ tạo ra các phản ứng chậm hoặc không phản ứng mạnh.
H2SO4 loãng không tác dụng với muối chứa kim loại kiềm
Muối của kim loại kiềm (như NaCl, KCl, NaOH, KOH) là các hợp chất có tính bazơ mạnh và có khả năng tương tác với axit, tạo ra phản ứng trung hòa. Khi muối của kim loại kiềm tác dụng với H2SO4 loãng, phản ứng trung hòa xảy ra giữa bazơ và axit, do đó không có phản ứng khí thải được tạo ra.
Phản ứng trung hòa này được mô tả như sau:
H2SO4 + NaCl → NaHSO4 + HCl
Trong phản ứng trên, H2SO4 loãng tác dụng với muối NaCl để tạo ra muối NaHSO4 và axit HCl. Axit HCl được tạo ra trong phản ứng là khí clo, là một loại khí độc hại.
Tóm lại, muối của kim loại kiềm không tác dụng với H2SO4 loãng vì phản ứng trung hòa giữa axit và bazơ, do đó không có khí thải độc hại được tạo ra.
H2SO4 loãng không tác dụng với Hydrocacbon không no
Hydrocacbon không no (ví dụ như etylen, propylen, butylen…) là các hợp chất hữu cơ không có nhóm chức hoạt động tương tác với axit, do đó chúng không tác dụng với axit sulfuric loãng (H2SO4).
Mặc dù trong điều kiện nhiệt độ và áp suất phù hợp, axit sulfuric có thể phân hủy hydrocacbon để tạo ra khí sulfat và khí hydro, nhưng phản ứng này cần nhiệt độ cao và nồng độ axit cao hơn so với H2SO4 loãng. Vì vậy, trong điều kiện bình thường, H2SO4 loãng không phản ứng với hydrocacbon không no.
Tuy nhiên, cần lưu ý rằng khi nồng độ axit sulfuric tăng lên và nhiệt độ cao hơn, các hydrocacbon có thể phân hủy để tạo ra sản phẩm phản ứng, và phản ứng này có thể trở nên nguy hiểm nếu không được kiểm soát tốt.
H2SO4 loãng không tác dụng với kim loại eddy
Kim loại eddy (hay kim loại kiềm nhóm 1) bao gồm lithium (Li), sodium (Na), potassium (K), rubidium (Rb) và cesium (Cs). Với các kim loại này, H2SO4 loãng không tác dụng vì chúng có khả năng tạo thành một màng bảo vệ bên ngoài bề mặt kim loại, ngăn chặn sự tác dụng giữa axit và kim loại.
Khi kim loại eddy tiếp xúc với không khí, nó sẽ bị oxy hóa và tạo ra một lớp oxit bảo vệ trên bề mặt kim loại. Màng này giúp bảo vệ kim loại tránh khỏi tác dụng của axit, bởi vì nó ngăn chặn sự tiếp xúc giữa axit và kim loại. Hơn nữa, khi kim loại eddy tác dụng với H2SO4, muối sulfat và khí hydro sẽ được tạo ra, nhưng cũng có thể có nguy cơ tạo thành một lớp sulfat bảo vệ bên ngoài kim loại, gây trở ngại cho sự tiếp xúc giữa axit và kim loại.
Do đó, kim loại eddy không phản ứng với H2SO4 loãng bởi vì chúng tạo ra một màng bảo vệ bên ngoài bề mặt kim loại, ngăn chặn sự tác dụng giữa axit và kim loại. Tuy nhiên, nếu axit sulfuric được tăng độ cô đặc và nhiệt độ tăng cao, kim loại eddy có thể phản ứng với axit để tạo ra muối sulfat và khí hydro, và trong một số trường hợp có thể làm giảm hoặc phá huỷ lớp bảo vệ bên ngoài kim loại.
H2SO4 loãng không tác dụng với vàng, bạc
Vàng và bạc đều là kim loại edymet (hay còn gọi là kim loại có giá trị) và có khả năng tạo ra một lớp oxit bảo vệ trên bề mặt kim loại, ngăn chặn sự tác dụng giữa axit sulfuric loãng và kim loại.
Khi tác dụng với không khí, vàng và bạc tạo ra một lớp oxit bảo vệ trên bề mặt kim loại, giúp bảo vệ chúng khỏi sự oxy hóa. Lớp bảo vệ này cũng ngăn chặn sự tiếp xúc giữa axit sulfuric và kim loại, do đó, H2SO4 loãng không tác dụng với vàng và bạc.
Ngoài ra, vàng và bạc không phản ứng với axit sulfuric cũng do tính bền vững và độ ổn định của các ion trung gian trong quá trình phản ứng. Các ion trung gian này bao gồm ion hidroxit (OH-) và ion sulfat (SO4(2-)) và chúng được tạo ra trong quá trình tác dụng giữa axit và kim loại. Tuy nhiên, do tính bền vững của liên kết giữa các nguyên tử trong phân tử và tính ổn định của các ion trung gian, các phản ứng giữa vàng, bạc và axit sulfuric rất chậm và không có sự xảy ra rõ ràng.
Tóm lại, H2SO4 loãng không tác dụng với vàng và bạc do tính bền vững và độ ổn định của các ion trung gian trong quá trình phản ứng cũng như khả năng của vàng và bạc tạo ra một lớp oxit bảo vệ trên bề mặt kim loại.
H2SO4 loãng không tác dụng với Platina(Pt)
Platina (Pt) là một kim loại edymet (hay còn gọi là kim loại có giá trị), và tương tự như vàng và bạc, nó có khả năng tạo ra một lớp oxit bảo vệ trên bề mặt kim loại, ngăn chặn sự tác dụng giữa axit sulfuric loãng và kim loại.
Khi tác dụng với không khí, platina tạo ra một lớp oxit bảo vệ trên bề mặt kim loại, giúp bảo vệ nó khỏi sự oxy hóa. Lớp bảo vệ này cũng ngăn chặn sự tiếp xúc giữa axit sulfuric và kim loại, do đó, H2SO4 loãng không tác dụng với platina.
Ngoài ra, platina không phản ứng với axit sulfuric cũng do tính bền vững và độ ổn định của các ion trung gian trong quá trình phản ứng. Các ion trung gian này bao gồm ion hidroxit (OH-) và ion sulfat (SO4(2-)) và chúng được tạo ra trong quá trình tác dụng giữa axit và kim loại. Tuy nhiên, do tính bền vững của liên kết giữa các nguyên tử trong phân tử và tính ổn định của các ion trung gian, các phản ứng giữa platina và axit sulfuric rất chậm và không có sự xảy ra rõ ràng.
Tóm lại, H2SO4 loãng không tác dụng với platina do tính bền vững và độ ổn định của các ion trung gian trong quá trình phản ứng cũng như khả năng của platina tạo ra một lớp oxit bảo vệ trên bề mặt kim loại.
Các kim loại tác dụng được với H2SO4 loãng
H2SO4 loãng là một axit mạnh và có khả năng tác dụng với nhiều kim loại khác nhau. Dưới đây là một số ví dụ về các kim loại thường tác dụng được với axit sulfuric loãng:
Kẽm (Zn)
Khi kẽm tác dụng với H2SO4 loãng, phản ứng xảy ra như sau:
Zn + H2SO4 → ZnSO4 + H2
Trong đó, kẽm (Zn) phản ứng với axit sulfuric (H2SO4) để tạo ra ion kẽm sulfat (ZnSO4) và khí hiđro (H2).
Đây là một phản ứng oxi-hoá khử, trong đó kẽm bị oxi hóa và khí hiđro được khử. Trong phản ứng này, axit sulfuric đóng vai trò là chất oxi hóa, chấp nhận các electron từ kẽm, trong khi kẽm đóng vai trò là chất khử, trao đổi electron với axit sulfuric để tạo ra ion kẽm sulfat và khí hiđro.
Phản ứng giữa kẽm và H2SO4 loãng rất nhanh và tạo ra một lượng lớn khí hiđro. Kết quả của phản ứng này là dung dịch axit sulfat loãng kèm theo ion kẽm sulfat.
Sắt (Fe)
Sắt có thể tác dụng với H2SO4 loãng để tạo ra ion sắt sulfat và khí hiđro theo phương trình:
Fe + H2SO4 → FeSO4 + H2
Trong phản ứng này, sắt (Fe) bị oxi hóa và axit sulfuric (H2SO4) bị khử. Axit sulfuric đóng vai trò là chất oxi hóa và chấp nhận electron từ sắt, trong khi sắt đóng vai trò là chất khử và trao đổi electron với axit sulfuric để tạo ra ion sắt sulfat và khí hiđro.
Phản ứng giữa sắt và H2SO4 loãng là phản ứng exothermic, tức là phản ứng tạo ra nhiệt. Nếu sử dụng H2SO4 đặc thì phản ứng sẽ cực kỳ mạnh và phát ra nhiều khí SO2, do đó phản ứng thường được thực hiện với axit sulfuric loãng để tránh các vấn đề an toàn và môi trường.
Dung dịch sau khi phản ứng chứa ion sắt sulfat (FeSO4) có màu xanh lá cây.
Nhôm (Al)
Nhôm không tác dụng với H2SO4 loãng bởi vì nhôm được bảo vệ bởi lớp oxit nhôm bền vững trên bề mặt kim loại. Lớp oxit nhôm này ngăn cản axit tác động vào kim loại bên trong.
Phương trình hoá học thể hiện phản ứng giữa nhôm và H2SO4 loãng như sau:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Tuy nhiên, phản ứng này chỉ xảy ra khi H2SO4 được sử dụng ở nồng độ cao và nóng chảy, vì trong trường hợp này axit có đủ năng lượng để phá hủy lớp oxit nhôm bảo vệ trên bề mặt kim loại. Sau đó, kim loại nhôm bị oxi hóa và phản ứng tạo ra ion nhôm sulfat và khí hiđro.
Nếu sử dụng H2SO4 loãng, thì phản ứng giữa nhôm và axit không xảy ra bởi vì lớp oxit nhôm bảo vệ trên bề mặt kim loại chống lại sự tác động của axit.
Magiê (Mg)
Magie không tác dụng với H2SO4 loãng bởi vì magie có lớp oxit magie bền vững trên bề mặt kim loại, ngăn cản axit tác động vào kim loại bên trong. Lớp oxit magie này còn được gọi là lớp oxit bảo vệ và nó bảo vệ magie khỏi bị oxi hóa bởi axit sulfuric.
Phương trình hoá học thể hiện phản ứng giữa magie và H2SO4 loãng như sau:
Mg + H2SO4 → MgSO4 + H2
Tuy nhiên, phản ứng này chỉ xảy ra khi H2SO4 được sử dụng ở nồng độ cao và nóng chảy, vì trong trường hợp này axit có đủ năng lượng để phá hủy lớp oxit magie bảo vệ trên bề mặt kim loại. Sau đó, kim loại magie bị oxi hóa và phản ứng tạo ra ion magie sulfat và khí hiđro.
Nếu sử dụng H2SO4 loãng, thì phản ứng giữa magie và axit không xảy ra bởi vì lớp oxit magie bảo vệ trên bề mặt kim loại chống lại sự tác động của axit.
Đồng (Cu)
Đồng tác dụng với H2SO4 loãng để tạo ra ion đồng và khí sunfurơ theo phương trình:
Cu + H2SO4 → CuSO4 + SO2 + 2H2O
Trong phản ứng này, đồng bị oxi hóa thành ion đồng dương (Cu2+) và H2SO4 bị khử thành khí sunfurơ và nước. Sulfur dioxide là sản phẩm khử duy nhất trong trường hợp này, bởi vì nồng độ H2SO4 loãng không đủ để tạo ra ion sulfat (SO42-), và do đó, không có phản ứng oxi hóa khác xảy ra.
Tuy nhiên, nếu sử dụng H2SO4 đặc, phản ứng giữa đồng và axit sẽ khác, và sẽ tạo ra ion đồng (II) sulfat (CuSO4) và khí sunfurơ:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Canxi (Ca)
Canxi (Ca) tác dụng với H2SO4 loãng để tạo ra khí hidro (H2) và muối canxi sulfat (CaSO4). Phương trình phản ứng hoá học là:
Ca + H2SO4 → CaSO4 + H2
Trong quá trình này, H2SO4 loãng tác dụng với canxi để tạo ra muối canxi sulfat kết tủa và khí hidro thoát ra. Muối canxi sulfat thường được sử dụng làm nguyên liệu trong sản xuất vật liệu xây dựng và trang trí như sơn, xi măng, gạch và vật liệu làm đường. Còn khí hidro được sử dụng trong nhiều ngành công nghiệp như sản xuất dung dịch làm mát, sản xuất kim loại và nhiên liệu.
Tuy nhiên, phản ứng này chỉ xảy ra khi H2SO4 loãng được sử dụng, trong khi đó nếu sử dụng H2SO4 đậm đặc, nó có thể gây ra phản ứng quá mạnh và gây nguy hiểm cho người làm việc.
Ngoài ra, axit sulfuric loãng cũng có thể tác dụng với nhiều kim loại khác như niken (Ni), bạc (Ag), titan (Ti), và một số kim loại hiếm như tungsten (W) và tantalum (Ta). Tuy nhiên, tốc độ và tính chất của phản ứng phụ thuộc vào tính chất của từng kim loại và điều kiện thực hiện phản ứng.
Ứng dụng của H2SO4 loãng trong đời sống
H2SO4 loãng (axit sulfuric loãng) được sử dụng rộng rãi trong đời sống và trong nhiều ngành nghề khác nhau, bao gồm:
- Trong sản xuất phân bón: H2SO4 loãng được sử dụng để sản xuất phân bón, bởi vì axit này có tính khử cao và có thể giúp chuyển đổi amoniac (NH3) thành muối amoni sulfat (NH4)2SO4, một loại phân bón giàu nitơ và lưu huỳnh.
- Trong sản xuất axit photphoric: H2SO4 loãng được sử dụng trong sản xuất axit photphoric, một loại axit có tính ổn định và được sử dụng trong nhiều ứng dụng công nghiệp.
- Trong sản xuất thuốc nhuộm: H2SO4 loãng được sử dụng trong sản xuất thuốc nhuộm để giúp tăng tính ổn định và cải thiện màu sắc của thuốc nhuộm.
- Trong sản xuất chất tẩy rửa: H2SO4 loãng được sử dụng làm thành phần của chất tẩy rửa để loại bỏ các chất bẩn và mảnh vụn khác nhau.
- Trong sản xuất xà phòng và chất tẩy: H2SO4 loãng được sử dụng để sản xuất xà phòng và các chất tẩy khác, bao gồm cả chất tẩy rửa và chất tẩy như đá vôi.
- Trong sản xuất đường: H2SO4 loãng được sử dụng trong sản xuất đường để giúp tách các thành phần của mía đường.
- Trong sản xuất giấy: H2SO4 loãng được sử dụng để xử lý các thành phần của cây để sản xuất giấy.
H2SO4 loãng có rất nhiều ứng dụng trong công nghiệp, một số ứng dụng chính bao gồm:
- Sản xuất phân bón: H2SO4 được sử dụng để sản xuất phân bón, đặc biệt là phân bón photphat và kali. Nó được sử dụng để chuyển đổi các nguyên liệu khoáng chất thành các dạng phân bón dễ dàng hấp thụ hơn.
- Sản xuất axit nitrat: H2SO4 loãng là một thành phần quan trọng trong quá trình sản xuất axit nitrat, một hợp chất được sử dụng rộng rãi trong ngành công nghiệp hóa chất để sản xuất các sản phẩm từ súng đạn đến thuốc nổ.
- Sản xuất axit sunfuric đậm đặc: H2SO4 loãng cũng được sử dụng để sản xuất axit sulfuric đậm đặc, một chất lỏng không màu rất quan trọng trong ngành công nghiệp hóa chất.
Ngoài ra, H2SO4 loãng còn được sử dụng trong các ứng dụng khác nhau như sản xuất pin, bình điện, chất bảo vệ gỗ, chất tẩy trắng, và các sản phẩm hóa học khác. Tuy nhiên, cần cẩn trọng khi sử dụng H2SO4 loãng, vì đây là một chất axit mạnh và có tính ăn mòn cao, có thể gây nguy hiểm nếu không được sử dụng đúng cách.
Tác hại của H2SO4 loãng và biện pháp phòng tránh
Tác hại của H2SO4 loãng
H2SO4 loãng có thể gây ra nhiều tác hại đến sức khỏe và môi trường nếu sử dụng một cách không đúng cách hoặc không đảm bảo an toàn. Dưới đây là một số tác hại của H2SO4 loãng:
- Tác hại đến sức khỏe: H2SO4 loãng có tính chất ăn mòn cao, có thể gây bỏng và tổn thương đến da, mắt và đường hô hấp. Nếu hít phải hơi H2SO4 loãng, người ta có thể bị khó thở, đau đầu, mệt mỏi, chóng mặt, co giật và thậm chí là ngất đi.
- Tác hại đến môi trường: H2SO4 loãng có khả năng gây ảnh hưởng đến hệ thống sinh thái trong môi trường nước và đất. Nếu thải ra môi trường một cách không đúng cách, H2SO4 loãng có thể gây ra sự suy giảm đáng kể trong chất lượng nước và đất, ảnh hưởng đến sức khỏe của các loài sinh vật sống trong môi trường đó.
- Tác hại đến thiết bị: H2SO4 loãng cũng có thể ăn mòn và gây hư hỏng thiết bị, đặc biệt là các thiết bị bằng kim loại như ống dẫn, bồn chứa và đường ống.
Do đó, khi sử dụng H2SO4 loãng, cần tuân thủ các quy định về an toàn lao động và đảm bảo sử dụng đúng cách, cùng với việc lưu giữ, vận chuyển và xử lý một cách an toàn để tránh gây hại cho sức khỏe và môi trường.
Biện pháp phòng tránh rủi ro của H2SO4 loãng
H2SO4 là một chất ăn mòn và độc hại, do đó cần tuân thủ một số biện pháp phòng ngừa để tránh rủi ro khi sử dụng, vận chuyển hoặc lưu trữ chất này. Một số biện pháp phòng tránh rủi ro của H2SO4 bao gồm:
- Đeo đồ bảo hộ: Khi làm việc với H2SO4, người thực hiện cần đeo đồ bảo hộ như kính bảo hộ, găng tay chống ăn mòn và áo khoác chống ăn mòn để bảo vệ da và mắt khỏi ảnh hưởng của chất này.
- Sử dụng thiết bị an toàn: Cần sử dụng các thiết bị an toàn như bồn chứa chất ăn mòn, bồn chứa chất cấp nước và hệ thống hút chân không để đảm bảo an toàn trong quá trình sử dụng, vận chuyển và lưu trữ chất này.
- Đảm bảo thông gió: Khi sử dụng H2SO4, cần đảm bảo hệ thống thông gió đầy đủ để loại bỏ các khí độc hại và giảm thiểu nguy cơ cháy nổ.
- Lưu trữ đúng cách: H2SO4 cần được lưu trữ ở nơi khô ráo, thoáng mát và xa các chất dễ cháy, hút ẩm hoặc chất dễ phân hủy để tránh nguy cơ cháy nổ hoặc phát sinh khí độc.
- Sử dụng đúng cách: Khi sử dụng H2SO4, cần tuân thủ đầy đủ các quy định, hướng dẫn sử dụng và luôn chú ý đến các biểu hiện cảnh báo, như mùi hôi khó chịu, màu sắc và nhiệt độ để đảm bảo an toàn trong quá trình sử dụng.
Như vậy, chúng ta đã cùng tìm hiểu về những chất không tác dụng với H2SO4 loãng và cơ chế hoạt động của chúng. Trên đây là tất cả các thông tin liên quan trả lời cho câu hỏi H2SO4 loãng không tác dụng với chất nào? Hi vọng với những thông tin vừa chia sẻ, mọi người sẽ nắm rõ các phản ứng hóa học của H2SO4 cũng như ứng dụng của nó trong đời sống, công nghiệp.