HCl (Hydrochloric acid) là một chất lỏng không màu, không mùi và có tính ăn mòn mạnh. Đây là một hợp chất hóa học phổ biến được sử dụng rộng rãi trong nhiều ngành công nghiệp. Tuy nhiên, không phải tất cả các chất hoặc kim loại đều tác dụng với HCl. Trong bài viết này, hãy cùng Đáp Án Chuẩn tìm hiểu HCl không tác dụng với chất nào và vì sao lại như vậy.
HCl là chất gì?
HCl là công thức hóa học của axit clohidric, một loại axit mạnh có khả năng phân liên tục trong nước và tạo ra ion hidronium (H3O+). HCl được tạo ra tự nhiên trong dịch vị của các loài động vật để giúp tiêu hóa thức ăn, và nó cũng được sản xuất công nghiệp để sử dụng trong nhiều ứng dụng khác nhau, bao gồm sản xuất thuốc, chất tẩy rửa, chất đóng gói và sản xuất kim loại.
HCl cũng là một chất phân tích quan trọng trong phòng thí nghiệm. Nó được sử dụng để điều chỉnh độ pH của các dung dịch, tạo ra các muối clo và các hợp chất clo khác. HCl cũng được sử dụng để tẩy trắng và khử trùng các bề mặt và sản phẩm.
Tuy nhiên, HCl cũng có những tác động tiêu cực. Khi thải vào môi trường, HCl có thể gây ô nhiễm môi trường và ảnh hưởng đến sức khỏe con người và động vật. Do đó, việc sử dụng HCl cần được quản lý và giám sát chặt chẽ để đảm bảo an toàn cho con người và môi trường.
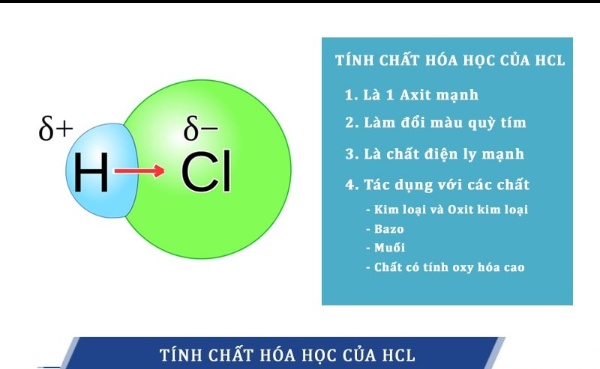
Tính chất hóa học của HCl
HCl là một chất lỏng không màu, có mùi khó chịu và có tính ăn mòn mạnh. Nếu tiếp xúc với da, mắt hoặc hô hấp, HCl có thể gây ra các vấn đề sức khỏe nghiêm trọng. Vì vậy, khi sử dụng HCl, cần đeo kính bảo hộ, khẩu trang và găng tay để bảo vệ sức khỏe.
Dưới đây là một số tính chất hóa học của HCl:
- Tính axit: HCl là một axit mạnh và có khả năng phản ứng với các base để tạo ra muối và nước. Ví dụ: HCl + NaOH → NaCl + H2O.
- Tính oxi hóa: HCl không có tính oxi hóa, nghĩa là nó không có khả năng tăng hay giảm số oxi hóa của các chất khác.
- Tính khử: HCl không có tính khử, nghĩa là nó không có khả năng giảm hay tăng số oxi hóa của các chất khác.
- Tính phản ứng với kim loại: HCl có tính ăn mòn mạnh và có thể phản ứng với kim loại để tạo ra muối và khí hidro. Ví dụ: Zn + 2HCl → ZnCl2 + H2.
- Tính phản ứng với oxit kim loại: HCl có khả năng phản ứng với các oxit kim loại để tạo ra muối và nước. Ví dụ: CuO + 2HCl → CuCl2 + H2O.
- Tính phản ứng với cacbonat: HCl có khả năng phản ứng với cacbonat để tạo ra muối, nước và khí CO2. Ví dụ: CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
- Tính chất của dung dịch: Dung dịch HCl có tính axit mạnh, có độ pH khoảng 1 và có tính ăn mòn cao.
Trên đây là một số tính chất hóa học cơ bản của HCl. Các tính chất này là cơ sở cho việc sử dụng và ứng dụng của HCl trong các lĩnh vực khác nhau.
Những kim loại không tác dụng với HCl
Vàng (Au) không tác dụng với HCl
HCl (axit clohidric) không tác dụng với vàng (Au) bởi vì vàng là một kim loại không hoạt động, có độ bền cao về mặt hóa học. Các liên kết hóa học giữa các nguyên tử vàng trong phân tử vàng rất chặt chẽ, khó bị phá vỡ bởi các tác nhân hóa học.
HCl là một axit mạnh và có khả năng tác dụng với nhiều kim loại khác, nhưng không tác dụng với vàng. Điều này là do các phân tử HCl không có độ oxi hóa đủ lớn để oxi hóa vàng thành các ion vàng dương. Trong điều kiện thường, các nguyên tử vàng bền vững trong môi trường axit và không phản ứng với HCl.
Tuy nhiên, khi nhiệt độ cao và áp suất cao được sử dụng, vàng có thể được oxi hóa thành các ion vàng dương và phản ứng với HCl, tạo thành các muối vàng, chẳng hạn như natri vàng sunfat (Na2[AuCl4]).
Bạc (Ag) không tác dụng với HCl
HCl (axit clohidric) không tác dụng với bạc (Ag) bởi vì bạc là một kim loại không hoạt động, có độ bền cao về mặt hóa học. Các liên kết hóa học giữa các nguyên tử bạc trong phân tử bạc rất chặt chẽ, khó bị phá vỡ bởi các tác nhân hóa học.
HCl là một axit mạnh và có khả năng tác dụng với nhiều kim loại khác, nhưng không tác dụng với bạc. Điều này là do các phân tử HCl không có độ oxi hóa đủ lớn để oxi hóa bạc thành các ion bạc dương. Trong điều kiện thường, các nguyên tử bạc bền vững trong môi trường axit và không phản ứng với HCl.
Tuy nhiên, bạc có thể phản ứng với HCl đặc với sự hiện diện của oxi hoá chất mạnh như HNO3 (axit nitric). Trong quá trình này, HNO3 sẽ oxi hóa bạc thành các ion bạc dương, trong khi HCl sẽ tạo ra ion clo âm để kết hợp với ion bạc dương để tạo ra muối bạc clorua (AgCl).
Plat (Pt) không tác dụng với HCl
HCl (axit clohidric) không tác dụng với plat (Pt) bởi vì plat là một kim loại có độ âm điện cao, liên kết ion hóa của các nguyên tử plat rất chặt chẽ và bền vững trong môi trường axit. Các nguyên tử plat trong phân tử plat có mật độ điện tích cao và bán kính nhỏ, khiến cho chúng tạo thành các liên kết kim rất mạnh.
Các phân tử HCl không có độ oxi hóa đủ lớn để oxi hóa các nguyên tử plat thành các ion plat dương. Cụ thể, trong quá trình phản ứng giữa HCl và plat, các nguyên tử clo trong phân tử HCl sẽ tương tác với các điện tử tự do của kim loại plat và tạo ra một lớp phủ bảo vệ bên ngoài kim loại. Lớp phủ này ngăn chặn các phân tử HCl tiếp cận và phá vỡ cấu trúc liên kết của plat.
Ngoài ra, plat có khả năng tạo ra một lớp oxit mỏng bảo vệ bên ngoài, ngăn chặn các tác nhân hóa học khác tiếp cận và phá vỡ cấu trúc liên kết của nó.
Vì vậy, dù HCl là một axit mạnh và có khả năng tác dụng với nhiều kim loại khác, nhưng nó không tác dụng với plat do các nguyên tử plat trong phân tử plat có cấu trúc liên kết mạnh mẽ và được bảo vệ bởi lớp phủ bảo vệ bên ngoài.
Iridium (Ir) không tác dụng với HCl
Iridium (Ir) là một kim loại hiếm có, có độ âm điện cao và liên kết ion hóa của các nguyên tử iridium rất chặt chẽ và bền vững trong môi trường axit. Các nguyên tử iridium trong phân tử iridium có mật độ điện tích cao và bán kính nhỏ, khiến cho chúng tạo thành các liên kết kim rất mạnh.
Trong quá trình phản ứng giữa axit clohidric (HCl) và iridium, các nguyên tử clo trong phân tử HCl sẽ tương tác với các điện tử tự do của kim loại iridium và tạo ra một lớp phủ bảo vệ bên ngoài kim loại. Lớp phủ này ngăn chặn các phân tử HCl tiếp cận và phá vỡ cấu trúc liên kết của iridium.
Ngoài ra, iridium cũng có khả năng tạo ra một lớp oxit mỏng bảo vệ bên ngoài, ngăn chặn các tác nhân hóa học khác tiếp cận và phá vỡ cấu trúc liên kết của nó.
Do đó, dù HCl là một axit mạnh và có khả năng tác dụng với nhiều kim loại khác, nhưng nó không tác dụng với iridium do các nguyên tử iridium trong phân tử iridium có cấu trúc liên kết mạnh mẽ và được bảo vệ bởi lớp phủ bảo vệ bên ngoài.
Osmium (Os) không tác dụng với HCl
Osmium (Os) là một kim loại có cấu trúc tinh thể rất chặt chẽ và mật độ cao, với cấu trúc tinh thể của nó chứa nhiều liên kết kim rất mạnh. Điều này làm cho kim loại osmium có khả năng chịu đựng và bền vững trong môi trường hóa học khắc nghiệt.
Trong quá trình tác dụng của axit clohidric (HCl) với kim loại osmium, phân tử HCl sẽ phân ly thành ion H+ và Cl-. Ion H+ sẽ tương tác với các điện tử tự do của kim loại osmium, tuy nhiên do osmium có cấu trúc tinh thể mật độ cao với liên kết kim mạnh nên các điện tử tự do này khó bị tác động và không thể tạo ra phản ứng hóa học.
Hơn nữa, kim loại osmium có khả năng tạo ra một lớp phủ bảo vệ bên ngoài, gọi là oxit osmium (OsO4), khi tác động của khí O2 trong không khí. Lớp phủ này ngăn chặn sự tương tác giữa HCl và osmium, giúp bảo vệ kim loại osmium khỏi sự ăn mòn hoặc phá vỡ cấu trúc của nó.
Vì vậy, tổng hợp lại, osmium không tác dụng với HCl do cấu trúc liên kết mạnh và bền vững của kim loại osmium, cùng với lớp phủ bảo vệ oxit osmium bên ngoài, đã ngăn chặn sự tương tác giữa HCl và kim loại osmium.
Rhenium (Re) không tác dụng với HCl
Rhenium (Re) là một kim loại chịu ăn mòn và có khả năng tác dụng với axit. Khi Rhenium (Re) tác dụng với HCl, phân tử HCl sẽ phân ly thành ion H+ và Cl-. Ion H+ sẽ tương tác với bề mặt của kim loại Rhenium (Re), làm cho nó bị ăn mòn hoặc tạo ra muối axit tương ứng của Rhenium (ReClx).
Tuy nhiên, tốc độ phản ứng giữa Rhenium và HCl khá chậm, và phản ứng này sẽ diễn ra duy trì trong một khoảng thời gian ngắn do lớp phủ bảo vệ bên ngoài của oxit Rhenium (ReO3) hoặc các hợp chất Rhenium khác. Lớp phủ này giúp bảo vệ Rhenium khỏi sự ăn mòn và phá vỡ cấu trúc của nó.
Tổng hợp lại, Rhenium (Re) có khả năng tác dụng với HCl và bị ăn mòn trong môi trường axit. Tuy nhiên, lớp phủ bảo vệ bên ngoài của oxit Rhenium hoặc các hợp chất khác giúp bảo vệ Rhenium khỏi sự ăn mòn hoặc phá vỡ cấu trúc của nó.
HCl đặc không tác dụng với chất nào
HCl đặc không tác dụng với đường
HCl đặc là một axit mạnh và có tính ăn mòn cao, tuy nhiên, nó không tác dụng với đường (glucose) hoặc các loại đường khác như fructose, lactose, sucrose, v.v. Điều này là do đường không chứa các nhóm chức amine hoặc hydroxyl phản ứng với axit để tạo thành muối.
HCl đặc thường tác dụng với các chất có tính kiềm hoặc oxit của kim loại để tạo thành muối, ví dụ như tạo ra muối cloua với natri (NaCl) hoặc kẽm (ZnCl2), tạo ra muối sunfat với photpho (P2O5) hoặc natri sunfat (Na2SO4).
Tuy nhiên, trong một số điều kiện đặc biệt, HCl đặc vẫn có thể tác dụng với đường để tạo ra các sản phẩm phản ứng khác nhau, ví dụ như trong quá trình hydrolysis của cellulose thành glucoza dưới điều kiện nhiệt độ và áp suất cao, hoặc khi đường được xử lý bằng HCl đặc trong điều kiện đặc biệt để sản xuất các hợp chất hữu cơ khác.
HCl đặc không tác dụng với Al(OH)3
HCl đặc không tác dụng với Al(OH)3 vì Al(OH)3 là một chất có tính kiềm yếu và có khả năng trung hòa axit. Khi HCl đặc được thêm vào dung dịch Al(OH)3, các ion H+ của axit HCl sẽ tương tác với các ion OH- của Al(OH)3, hình thành nước (H+ + OH- -> H2O), trong khi Al3+ được giữ nguyên.
Phản ứng giữa HCl đặc và Al(OH)3 có thể được miêu tả bởi phương trình:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Trong phản ứng này, Al(OH)3 tương tác với HCl để tạo thành AlCl3 và nước.
Điều này cũng giải thích tại sao Al(OH)3 thường được sử dụng để trung hòa axit trong nhiều ứng dụng, bao gồm trong sản xuất thuốc nhuộm, chất tẩy rửa và trong sản xuất giấy. Nó cũng được sử dụng trong quá trình xử lý nước để loại bỏ các chất hữu cơ và các ion kim loại khác.
HCl đặc không tác dụng với Zn(OH)2
HCl đặc không tác dụng với Zn(OH)2 vì Zn(OH)2 là một chất có tính kiềm yếu và có khả năng trung hòa axit. Khi HCl đặc được thêm vào dung dịch Zn(OH)2, các ion H+ của axit HCl sẽ tương tác với các ion OH- của Zn(OH)2, hình thành nước (H+ + OH- -> H2O), trong khi Zn2+ được giữ nguyên.
Phản ứng giữa HCl đặc và Zn(OH)2 có thể được miêu tả bởi phương trình:
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Trong phản ứng này, Zn(OH)2 tương tác với HCl để tạo thành ZnCl2 và nước.
Điều này cũng giải thích tại sao Zn(OH)2 thường được sử dụng để trung hòa axit trong nhiều ứng dụng, bao gồm trong sản xuất thuốc nhuộm, chất tẩy rửa và trong sản xuất giấy. Nó cũng được sử dụng trong quá trình xử lý nước để loại bỏ các chất hữu cơ và các ion kim loại khác.
HCl đặc không tác dụng với Au, Ag
HCl đặc không tác dụng với Au (vàng) và Ag (bạc) bởi vì chúng đều là kim loại không hoạt động (không hoà tan trong axit) ở điều kiện thường.
Mặc dù HCl là một axit mạnh, nó không tác dụng với vàng và bạc bởi vì các kim loại này có độ bền hoá học cao, không bị oxi hóa hoặc khử dễ dàng. Do đó, các kim loại này thường được sử dụng trong các ứng dụng vật liệu, trang sức và trong sản xuất tiền tệ.
Tuy nhiên, các hợp chất của vàng và bạc có thể bị tác động bởi HCl đặc, ví dụ như natri vàng sunfat (Na2[AuCl4]) hoặc muối bạc clorua (AgCl) có thể tan trong axit để tạo ra các ion phức của kim loại.
HCl lỏng không tác dụng với chất nào
HCl lỏng không tác dụng với Nhựa PVC
Nhựa PVC (polyvinyl chloride) là một loại polymer được tạo ra từ monomer vinyl chloride, có cấu trúc phân tử là một chuỗi các đơn vị monomer vinyl chloride liên kết với nhau. Nhựa PVC có tính chất chống ăn mòn và không bị tác động bởi axit và kiềm yếu.
HCl lỏng trong điều kiện thông thường là dung dịch có nồng độ từ 35-38%. Khi tiếp xúc với Nhựa PVC, HCl lỏng sẽ không tác dụng hoặc gây hại cho vật liệu này do nhựa PVC không chứa nhóm chức có thể tương tác hoặc phản ứng với axit.
Ngoài ra, nhựa PVC còn có khả năng chống lại các tác nhân hóa học khác như các dung môi hữu cơ, các dung dịch kiềm và một số acid đặc biệt khác, làm cho nó được sử dụng rộng rãi trong các ứng dụng đòi hỏi tính chống ăn mòn, chống ăn mòn bởi hóa chất.
HCl lỏng không tác dụng với thủy tinh
HCl lỏng trong điều kiện thông thường là dung dịch có nồng độ từ 35-38%. Thủy tinh là một loại vật liệu không phản ứng với axit yếu như HCl, vì vậy HCl lỏng không tác dụng với thủy tinh. Điều này xảy ra vì thủy tinh được tạo thành từ một mạng lưới các phân tử silica (SiO2) không chứa các nhóm chức có thể phản ứng với axit yếu như HCl.
Tuy nhiên, trong điều kiện nồng độ HCl cao hơn, thủy tinh sẽ bị ăn mòn và hình thành các ion khí HCl và các sản phẩm phụ khác. Trong trường hợp này, thủy tinh không thể chịu được sức mạnh tác động của axit HCl và sẽ bị phá hủy.
Ứng dụng của HCl trong đời sống hằng ngày
HCl (axit clohidric) là một trong những axit quan trọng nhất và được sử dụng rộng rãi trong đời sống hằng ngày. Dưới đây là một số ứng dụng của HCl:
- Làm sạch bề mặt kim loại: HCl được sử dụng để làm sạch bề mặt kim loại trước khi sơn hoặc mạ. Axit HCl có khả năng tẩy rửa và loại bỏ các tạp chất trên bề mặt kim loại, làm tăng độ bóng và khả năng bám dính cho lớp phủ tiếp theo.
- Tẩy rửa và làm sạch trong gia đình: HCl được sử dụng trong các sản phẩm tẩy rửa và làm sạch trong gia đình như tẩy vết bẩn trên giày da, tẩy vết ố vàng trên gạch men và thiết bị vệ sinh nhà tắm.
- Tẩy tế bào chết: HCl được sử dụng để tẩy tế bào chết trên da. Nó thường được sử dụng trong các sản phẩm làm sạch da và sản phẩm chăm sóc da.
- Tẩy trắng và khử trùng: HCl cũng được sử dụng để tẩy trắng giấy và vải. Nó cũng có tính khử trùng, được sử dụng để diệt khuẩn và vi khuẩn trên bề mặt các sản phẩm y tế.
- Sản xuất muối: HCl được sử dụng để sản xuất các loại muối như muối ăn, muối hóa chất và muối tẩy rửa.
- Sản xuất axit clohidric: HCl được sản xuất để sản xuất axit clohidric được sử dụng trong nhiều ứng dụng công nghiệp, chẳng hạn như sản xuất phân bón và chất tẩy rửa.
Dưới đây là một số ứng dụng của HCl trong các lĩnh vực khác nhau:
- Công nghiệp hóa chất: HCl được sử dụng để sản xuất các hợp chất hóa học khác, chẳng hạn như clorua, axit perchloric, dầu ăn sốt, axit boric, muối amon, và thuốc diệt cỏ.
- Công nghiệp dầu khí: HCl được sử dụng để tách khí đốt từ dầu mỏ, làm sạch các ống dẫn dầu và cải thiện khả năng tách khí đốt.
- Công nghiệp thực phẩm: HCl được sử dụng trong sản xuất các sản phẩm thực phẩm, chẳng hạn như xử lý các hạt ngũ cốc để làm mềm chúng, tẩy trắng đường, và giữ vị chua trong các sản phẩm ăn chua.
- Công nghiệp dệt may: HCl được sử dụng để tẩy trắng và làm mềm sợi vải.
- Y tế: HCl được sử dụng để làm thuốc giảm đau, tiêu viêm, tiêu acid dạ dày và đặc biệt là trong điều trị bệnh do thiếu sắt.
- Công nghiệp xử lý nước: HCl được sử dụng để điều chỉnh độ pH của nước và để khử trùng nước uống.
- Công nghiệp kim loại: HCl được sử dụng để làm sạch kim loại trước khi sơn, mạ, hoặc đúc.
- Công nghiệp sản xuất bột giặt: HCl được sử dụng để điều chỉnh độ pH của các dung dịch trong quá trình sản xuất bột giặt.
Như vậy, HCl được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau và đóng vai trò quan trọng trong sản xuất và sản xuất nhiều sản phẩm khác nhau.
HCl có hại đến môi trường không?
HCl lỏng có hại không?
HCl lỏng thường được sử dụng trong các quá trình sản xuất, xử lý và tái chế kim loại, trong sản xuất dược phẩm và chất tẩy rửa. Việc tiếp xúc với HCl lỏng có thể gây bỏng da và mắt. Nếu HCl lỏng được xả ra vào môi trường mà không được xử lý đúng cách, nó có thể gây ô nhiễm nước và gây ảnh hưởng đến sự sống của các sinh vật trong môi trường nước.
HCl đặc có hại không?
HCl đặc được sử dụng trong công nghiệp để sản xuất các sản phẩm hóa học như chất tẩy rửa, thuốc nhuộm, thuốc trừ sâu và phân bón. Việc tiếp xúc với HCl đặc có thể gây bỏng da, mắt và đường hô hấp. Nếu HCl đặc được thải ra vào môi trường mà không được xử lý đúng cách, nó có thể gây ô nhiễm không khí và nước. HCl đặc trong nước cũng có thể gây ảnh hưởng đến độ pH của nước, ảnh hưởng đến sự sống của các loài sinh vật trong nước.
Cách khắc phục hậu quả của HCl đến môi trường
Để khắc phục tình trạng ô nhiễm môi trường do HCl, có thể thực hiện các biện pháp sau đây:
- Sử dụng các thiết bị kiểm soát ô nhiễm: Các nhà máy hoặc những cơ sở sản xuất sử dụng HCl nhiều có thể lắp đặt các thiết bị kiểm soát ô nhiễm như bộ lọc, bộ khử mùi, hệ thống xử lý nước thải và các thiết bị giảm thiểu khí thải để giảm thiểu lượng HCl xả ra môi trường.
- Sử dụng các phương pháp xử lý chất thải: Các phương pháp xử lý chất thải như phương pháp ủ phân hoặc phương pháp đốt cháy có thể được sử dụng để xử lý chất thải có chứa HCl.
- Tăng cường giám sát và tuân thủ quy định về môi trường: Việc giám sát và tuân thủ quy định về môi trường được thiết lập bởi các cơ quan chức năng để đảm bảo các nhà máy và cơ sở sản xuất sử dụng HCl tuân thủ các quy định về môi trường, đồng thời phát hiện và xử lý kịp thời các trường hợp xảy ra ô nhiễm môi trường.
- Tìm kiếm các sản phẩm và công nghệ thay thế: Nghiên cứu và sử dụng các sản phẩm và công nghệ thay thế không chứa HCl hoặc chứa lượng HCl ít hơn có thể giảm thiểu tác động của HCl đến môi trường.
- Tăng cường tư vấn và giáo dục: Tăng cường tư vấn và giáo dục cho người dân và các doanh nghiệp về tác động của HCl đến môi trường, đồng thời tăng cường nhận thức và trách nhiệm của cộng đồng trong việc bảo vệ môi trường.
Trên đây là tất cả các thông tin liên quan trả lời cho câu hỏi HCl không tác dụng với chất nào. Hy vọng với những thông tin mà Đáp Án Chuẩn vừa chia sẻ, sẽ giúp mọi người áp dụng HCl đúng cách trong các lĩnh vực khác nhau, từ công nghiệp đến đời sống hằng ngày cũng như hạn chế hậu quả mà nó mang đến cho môi trường sống của chúng ta.